


 ������״Ԫ���Ծ�ϵ�д�
������״Ԫ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ͭ��Һ������������Һ��Ӧ��Cu2++2OH-�TCu��OH��2�� |
| B��ʯ��ʯ�������CO32-+2H+�TH2O+CO2�� |
| C��������Һ������������Һ��Ӧ��H++OH-�TH2O |
| D��Cu��AgNO3��Һ��Ӧ��Cu+Ag+�TCu2++Ag |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��NaHSO3��Һˮ�⣺HSO-3+H2O�TH2SO3+OH- |
| B����2ml0.001mol?L-1����ʯ��ˮ���뼸��0.001mol?L-1С�մ���Һ��HCO-3+Ca2++OH-�TCaCO3��+H2O |
| C����KAl��SO4��2��Һ�еμ�Ba��OH��2��Һ��ʹSO42-ȫ��������Al3++6OH-+3SO42-+3Ba2+�T2Al��OH��3��+3BaSO4�� |
| D����������ˮ����SO2���壺SO2+2NH3?H2O�T2NH+4+SO32-+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����������ˮ��Ӧ��Na+2H2O=Na++2OH-+H2�� |
| B��������������Һ�к�������Һ��Ba2++2OH-+2H++SO42-=2H2O+BaSO4�� |
| C�������������������Ʒ�Ӧ��SiO2+2OH-=SiO32-+H2O |
| D��ʯ��ʯ�м������CO32-+2H+=H2O+CO2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ƬͶ���ռ���ҺAl+2OH-=AlO2-+H2�� |
| B����������Ͷ��ˮ��2O22-+2H2O=4OH-+O2�� |
| C��̼�����������CO32-+2H+=H2O+CO2�� |
| D�������Ƹ�ˮ��Ӧ2Na+2H2O=2Na++2OH-+H2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��FeCl3��Һ��Na2S��Һ��ϣ�2Fe3++3S2-+3H2O�T2Fe��OH��3��+3H2S�� | ||||
B����ͭ���缫���CuSO4��Һ��2Cu2++2H2O
| ||||
| C��NaHS���뷽��ʽ��NaHS?Na++HS- | ||||
| D��NH4Clˮ�ⷴӦ��NH4++2H2O?NH3?H2O+H3O+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��84����Һ�������Ͽ��ܲ���������ClO-+Cl-+2H+�TCl2��+H2O |
| B���ö��������ˮ��Ӧ���Ƶù��SiO2+H2O�TH2SiO3 |
| C��ʳ���뵰�Ƿ�Ӧ��CaCO3+2H+�TCa2++CO2��+H2O |
| D������������ȼ�գ�Fe+Cl2�TFeCl2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ��2��һ���¶��µ����ܵ����AmBn��ˮ��Һ�дﵽ�����ܽ�ƽ��ʱ����ƽ�ⳣ��
��2��һ���¶��µ����ܵ����AmBn��ˮ��Һ�дﵽ�����ܽ�ƽ��ʱ����ƽ�ⳣ��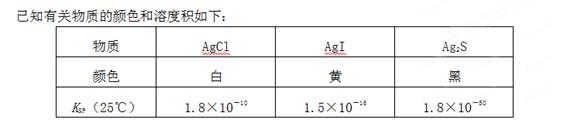

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��K+��Cl����MnO4����SO42�� | B��Na+��SiO32����NO3����CO32�� |
| C��Na+��NO3����SO42����HCO3�� | D��Na+��SO42����S2����ClO�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com