
 请根据下表,回答下列问题:(数据均在25℃时测定)
请根据下表,回答下列问题:(数据均在25℃时测定)| 化学式 | CH3COOH | H2CO3 | HClO | Cu(OH)2 |
| 相关常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 | Ksp=2×10-20 |
分析 (1)等浓度的酸溶液依据电离平衡常数比较大小,酸越弱对应盐水解程度越大,溶液碱性越强;
(2)常温下0.1mol•L-1的HClO溶液加水稀释过程平衡状态下微粒浓度减小,溶液中存在离子积常数,氢离子浓度减小,氢氧根离子浓度增大,温度不变平衡常数不变;
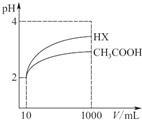
(3)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大;若将浓度为c1的NaOH溶液与0.1mol/L的HX等体积混合,所得溶液的pH=7,依据溶液中电荷守恒分析判断离子浓度大小,若将“0.1mol/L的HX”改为“pH=1的HX”,所得溶液的pH仍为7,HX电离平衡状态下氢离子浓度为0.1mol/L,则中和反应溶液呈中性需要氢氧化钠多;
(4)①由醋酸根的物料守恒分析;
②由电荷守恒分析;
(5)根据Ksp=c(Cu2+)•[c(OH-)]2=2×10-20,根据Cu2+离子的浓度计算OH-离子的浓度,根据水的离子积常数计算氢离子浓度,并以此计算溶液pH值.
Cu2+沉淀较为完全浓度降至原来的千分之一,根据Ksp求出OH-离子的浓度,再求pH.
解答 解:(1)电离平衡常数分析判断酸性大小为:CH3COOH>H2CO3>HClO>HCO3-,物质的量浓度为0.1mol•L-1的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,由水电离产生的H+由大到小的顺序是a>b>d>c,
故答案为:a>b>d>c;
(2)溶液中存在电离平衡HClO?H++ClO-,H2O?H++OH-,
A.加水稀释溶液中c(H+)减小,故A错误;
B.加水稀释促进电离,氢离子数增大,次氯酸分子减小,则$\frac{c({H}^{+})}{c(HClO)}$比值增大,故B错误;
C.溶液中存在离子积常数Kw=c(OH-)•c(H+),加水稀释氢离子浓度减小,氢氧根离子浓度增大,则$\frac{c(O{H}^{-})}{c({H}^{+})}$比值增大,故C错误;
D.$\frac{c(Cl{O}^{-})}{c(HClO)c(O{H}^{-})}$=$\frac{c(Cl{O}^{-})}{c(HClO)c(O{H}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Ka}{Kw}$,温度不变Ka、Kw不变,则比值不变,故D正确;
故答案为:D;
(3)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大,Ka(HX)>Ka(CH3COOH),若将浓度为c1的NaOH溶液与0.1mol/L的HX等体积混合,所得溶液的pH=7,c(OH-)=c(H+),电荷守恒为:c(Na+)+c(H+)=c(X-)+c(OH-),c(Na+)=c(X-),HX为弱酸,则c1<0.1mol/L,溶液中离子浓度大小关系为:c(Na+)=c(X-)>c(OH-)=c(H+),若将“0.1mol/L的HX”改为“pH=1的HX”,所得溶液的pH仍为7,氢氧化钠溶液提供氢氧根离子多于0.1mol/L,则c1>0.1mol/L,
故答案为:>;<;c(Na+)=c(X-)>c(OH-)=c(H+);>;
(4)①由醋酸根的物料守恒可知,n(CH3COOH)+n(CH3COO-)=0.1mol,故答案为:CH3COOH;CH3COO-;
②由电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(CH3COO-)+c(Cl-),则n(OH-)+n(CH3COO-)-n(H+)=n(Na+)-n(Cl-)=0.05mol,
故答案为:CH3COO-;OH-;
(5)某CuSO4溶液里c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,则应有c(OH-)≥$\sqrt{\frac{2×1{0}^{-20}}{0.02}}$mol/L=10-9mol/L,则c(H+)≤$\frac{1×1{0}^{-14}}{1{0}^{-9}}$mol/L=10-5mol/L,
所以pH≥-lg(10-5)=5,
Cu2+沉淀较为完全是的浓度为$\frac{0.2mol/L}{1000}$=2×10-4mol/L,
则c(OH-)=$\sqrt{\frac{2×1{0}^{-20}}{2×1{0}^{-4}}}$mol/L═10-8mol/L,
则c(H+)=$\frac{1×1{0}^{-14}}{1{0}^{-8}}$mol/L=10-6mol/L,
所以pH=-lg(10-6)=6,
故答案为:5;6
点评 本题考查盐类水解及酸性的比较、酸碱混合的计算和定性分析、pH与酸的稀释等知识,注意水解规律中越弱越水解和稀释中强的变化大来分析解答,注意电荷守恒和物料守恒的应用,综合性较大,题目难度中等.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水,浓H2SO4 | B. | 酸性KMnO4溶液,浓H2SO4 | ||
| C. | 溴水,烧碱溶液,浓硫酸 | D. | 浓H2SO4,酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验时酸或碱溅到眼中,应立即用水冲洗,并不断眨眼,不能用手搓揉眼睛 | |
| B. | 检验硫酸亚铁铵溶液中Fe2+的方法是:先滴加新制氨水后滴加KSCN溶液 | |
| C. | 证明钢铁吸收氧腐蚀的方法是:在镀锌铁皮上滴1~3滴含酚酞的饱和食盐水,静置1~2min,观察现象 | |
| D. | 因为氧化铁是一种碱性氧化物,所以常用作红色油漆和涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.
,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  表示某吸热反应分别在有、无催化剂的情况况下反应过程中的能量变化 | |
| B. |  表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的物质的量与NaOH溶液体积的关系,则三种离子的物质的量之比比为(Mg2+):(Al3+):n(NH4+)=2:3:2 | |
| C. | 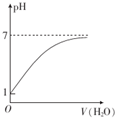 表示常温下0.10 mol•L-1的CH3COOH溶液加水稀释时溶液的pH变化 | |
| D. |  表示向10.00 mL 0.050 mol•L-1盐酸中逐滴加人0.025 mol•L-1的氨水时溶液的pH变化,其中 V1>20.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com