
| 1 |
| 3 |
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
| 0.15mol |
| 1mol/L |
| 0.65mol |
| 1mol/L |


科目:高中化学 来源: 题型:
| A、磷酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等 |
| B、6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14:1 |
| C、32g氧气所含的原子数目为2×6.02×1023 |
| D、CO的摩尔质量与NA个CO分子质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 4.0 |
| A、向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度 |
| B、四种溶液中,水的电离程度最大的是NaClO |
| C、常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3 |
| D、NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、检验C2H5Br中的Br元素时,将C2H5Br和NaOH溶液混合加热后,加硫酸酸化 |
| B、为提高KMnO4溶液的氧化能力,用浓盐酸将KMnO4溶液酸化 |
| C、检验蔗糖在稀硫酸中水解产生的葡萄糖,应先用NaOH溶液碱化后才能进一步检验 |
| D、检验溶液中是否含有SO42-时,先加氯化钡溶液后,再加稀盐酸酸化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
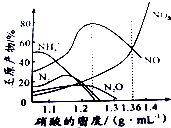 金属(M)的腐蚀是因为发生反应:M-ne-→Mn+.金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁的腐蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.
金属(M)的腐蚀是因为发生反应:M-ne-→Mn+.金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁的腐蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.查看答案和解析>>
科目:高中化学 来源: 题型:
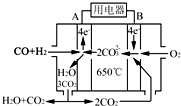 研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有AgCl沉淀生成 |
| B、无AgCl沉淀生成 |
| C、有沉淀生成但不是AgCl |
| D、无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com