
据报道,我国拥有的完全自主产权的氢氧燃料电池车已在北京奥运会期间为运动员提供了服务。某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
A.正极反应式为O2+2H2O+4e-—→4OH-
B.工作一段时间后,电解液中KOH的物质的量不变
C.该燃料电池的总反应方程式为2H2+O2===2H2O
D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
比较下列各组热化学方程式中ΔH的大小关系。
(1)S(s)+O2(g)===SO2(g) ΔH1
S(g)+O2(g)===SO2(g) ΔH2
ΔH1______ΔH2
(2)CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH2
ΔH1______ΔH2
(3)煤作为燃料有两种途径:
途径1——直接燃烧
C(s)+O2(g)===CO2(g) ΔH1<0
途径2——先制水煤气
C(s)+H2O(g)===CO(g)+H2(g) ΔH2>0
再燃烧水煤气:
2CO(g)+O2(g)===2CO2(g) ΔH3<0
2H2(g)+O2(g)===2H2O(g) ΔH4<0
ΔH1、ΔH2、ΔH3、ΔH4的关系式是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述是小明做完铜、锌原电池的实验后得出的结论和认识,你认为正确的是( )
A.构成原电池正极和负极的材料必须是两种金属
B.由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极
C.电子沿外导线由锌流向铜,通过硫酸溶液被氢离子得到而放出氢气
D.铜锌原电池工作时,若有13克锌被溶解,电路中就有0.4 mol电子通过
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.放热反应在常温下一定容易进行
B.植物的光合作用是把太阳能转化为热能的过程
C.反应是放热还是吸热是由反应物和生成物所具有的能量的相对大小决定的
D.凡是在加热或点燃条件下进行的反应都是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
有关热化学方 程式书写与对应表述均正确的是( )
程式书写与对应表述均正确的是( )
A.稀醋酸与0.1 mol·L-1 NaOH溶液反应:
H+(aq)+OH-(aq)====H2O(l) ΔH=-57.3 kJ·mol-1
B.氢气的燃烧热为285.5 kJ·mol-1, 则水分解的热化学方程式
2H2O(l)====2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
C.密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量。 则Fe(s)+S(s)====FeS(s) ΔH=-95.6 kJ·mol-1
D.已知2C(s)+O2(g)====2CO(g) ΔH=-221 kJ·mol-1,则可知C的燃烧热为110.5 kJ·m ol-1
ol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
将2 mol X和2 mol Y充入2 L的密闭容器中发生如下反应:X(g)+3Y(g)  2Z(g)+aQ(g),2 min达到平衡时生成0.8 mol Z,测得Q的浓度为
2Z(g)+aQ(g),2 min达到平衡时生成0.8 mol Z,测得Q的浓度为
0.4 mol·L-1,下列叙述错误的是( )
A.a的值为2
B.平衡时X的浓度为0.2  mol·L-1
mol·L-1
C.Y的转化率为60%
D.反应速率v(Y)=0.3 mol·(L·min)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,有关说法不正确的是( )
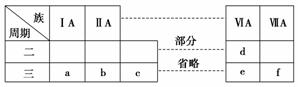
A.元素e的氧化物对应的水化物均为强酸
B.a、b、d、e四种元素的离子半径:e>d>a>b
C.b、f两种元素形成的化合物为离子化合物
D.a、c、e的最高价氧化物对应的水化物之间能够相互反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com