
| A. | 钠与水的反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 硅酸钠溶液中通入过量CO2:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- | |
| C. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 明矾溶液中加入过量的Ba(OH)2溶液:Al3++4OH-═AlO2-+2H2O |
分析 A.反应生成氢氧化钠和氢气;
B.反应生成硅酸和碳酸氢钠;
C.反应生成的HClO在离子反应中保留化学式;
D.反应生成硫酸钡、偏铝酸钾和水.
解答 解:A.钠与水的反应的离子反应为2Na+2H2O═2Na++2OH-+H2↑,故A正确;
B.硅酸钠溶液中通入过量CO2的离子反应为SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-,故B正确;
C.氯气与水反应的离子反应为Cl2+H2O═H++Cl-+HClO,故C错误;
D.明矾溶液中加入过量的Ba(OH)2溶液的离子反应为2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,故D错误;
故选AB.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:解答题

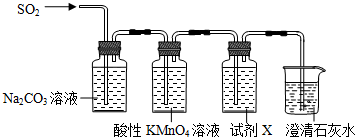
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.2 g | B. | 4.8 g | C. | 5.4 g | D. | 3.8 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
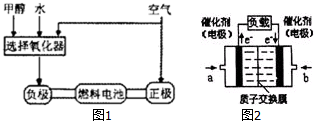
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| C. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 | |
| D. | 可用漂白粉和漂白液对地震后的受灾地区进行杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 物质 | 杂质 | 除杂质所选用的试剂或操作方法 |
| A | Mg | Al | 加入过量盐酸溶液,充分反应,过滤 |
| B | NaHCO3溶液 | Na2CO3溶液 | 加入足量氢氧化钡溶液,充分反应,过滤 |
| C | NO | NO2 | 通过盛有水的洗气瓶,再干燥 |
| D | FeCl3溶液 | FeCl2溶液 | 加入过量的铁粉,充分反应,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从分子中碳骨架形状分:异丁烷为链状有机化合物,甲苯为环状有机化合物 | |
| B. | 蒸馏常用于分离提纯液态有机混合物 | |
| C. | 核磁共振氢谱通常用于分析有机物的相对分子质量 | |
| D. | 对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com