

分析 (1)①铁离子能发生水解反应生成氢氧化铁胶体,胶体具有吸附性而净水;铁离子具有氧化性,能氧化铁生成亚铁离子;
②酸性条件下,氯酸根离子和亚铁离子发生氧化还原反应生成氯离子、铁离子和水,Cl元素化合价由+5价变为-1价、Fe元素化合价由+2价变为+3价,转移电子数为6,根据转移电子、电荷守恒及原子守恒配平方程式;
(2)酸性条件下,二氧化锰和碘离子发生氧化还原反应生成锰离子、碘和水;
(3)D的相对分子质量比C的相对分子质量大16,则D的分子式比C多一个O原子,E是强酸,当X是强酸时,A、B、C、D、E均含有同一元素,D为氧化物、Z为H2O,D为SO3,Y为O2,C为SO2,A为正盐,和酸反应生成硫化氢,硫化氢被氧气氧化生成SO2,所以B为H2S,A为硫化物;当X是强碱时,A、B、C、D、E均含有另一种元素,强碱和A反应生成B,B能被连续氧化生成氧化物D,D和水反应生成强酸E,则E为HNO3,D为NO2、Z为H2O、Y为O2、C为NO、B为NH3,A为含有铵根离子的盐,通过以上分析知,A为(NH4)2S,
结合题目分析解答.
解答 解:(1)①铁离子能发生水解反应生成氢氧化铁胶体,胶体具有吸附性而净水,离子方程式为Fe3++3H2O?Fe(OH)3(胶体)+3H+;铁离子具有氧化性,能氧化铁生成亚铁离子,离子方程式为2Fe3++Fe=3Fe2+,
故答案为:Fe3++3H2O?Fe(OH)3(胶体)+3H+;2Fe3++Fe=3Fe2+;
②酸性条件下,氯酸根离子和亚铁离子发生氧化还原反应生成氯离子、铁离子和水,Cl元素化合价由+5价变为-1价、Fe元素化合价由+2价变为+3价,转移电子数为6,根据转移电子、电荷守恒及原子守恒配平方程式为1ClO3-+6Fe2++6H+=1Cl-+6Fe3++3H2O,故答案为:1;6;6H+;1;6;3H2O
(2)酸性条件下,二氧化锰和碘离子发生氧化还原反应生成锰离子、碘和水,离子方程式为MnO2+4H++2I-=Mn2++I2+2H2O,
故答案为:MnO2+4H++2I-=Mn2++I2+2H2O;
(3)D的相对分子质量比C的相对分子质量大16,则D的分子式比C多一个O原子,E是强酸,当X是强酸时,A、B、C、D、E均含有同一元素,D为氧化物、Z为H2O,D为SO3,Y为O2,C为SO2,A为正盐,和酸反应生成硫化氢,硫化氢被氧气氧化生成SO2,所以B为H2S,A为硫化物;当X是强碱时,A、B、C、D、E均含有另一种元素,强碱和A反应生成B,B能被连续氧化生成氧化物D,D和水反应生成强酸E,则E为HNO3,D为NO2、Z为H2O、Y为O2、C为NO、B为NH3,A为含有铵根离子的盐,通过以上分析知,A为(NH4)2S,
①通过以上分析知,X是强酸时,B是硫化氢、Y是氧气、C是二氧化硫,反应方程式为2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,
故答案为:2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O;
②X是强酸时,E为浓硫酸、B为硫化氢,二者反应生成S和水,反应方程式为3H2S+H2SO4(浓)=4S↓+4H2O,
故答案为:3H2S+H2SO4(浓)=4S↓+4H2O;
③当X为强碱溶液时,B是氨气,氨气检验方法为湿润的红色石蕊试纸靠近变为蓝色或蘸有浓盐酸的玻璃棒靠近出现白烟,
故答案为:湿润的红色石蕊试纸靠近变为蓝色或蘸有浓盐酸的玻璃棒靠近出现白烟.
点评 本题考查无机物推断、盐类水解、氧化还原反应方程式的配平等知识点,侧重考查学生分析、推断及综合知识应用能力,明确元素化合物性质、物质之间的转化是解本题关键,知道氨气检验方法及现象,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 粗硅制备单晶硅不涉及氧化还原反应 | |
| B. | 硅胶常用做实验时和袋装食品、瓶装药品的干燥剂 | |
| C. | 纯净的硅可做光导纤维的原料 | |
| D. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
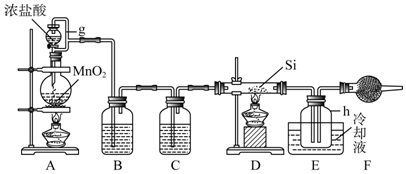
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl3 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -17.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 163 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加KSCN溶液 | B. | 先加硝酸根,再加硝酸酸化 | ||
| C. | 利用焰色反应 | D. | 先加盐酸酸化,再加氯化钡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-H | 414 | C-F | 489 | H-F | 565 | F-F | 158 |
| H-H | 436 | H-N | 391 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
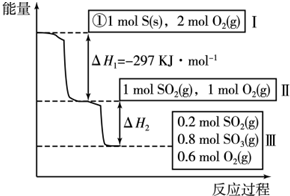 硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤.
硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤.| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol SO2、1mol O2 | 2mol SO3 | 4mol SO2、2mol O2、 |
| 平衡时n(SO3) | 1.6mol | n2 | n3 |
| 能量变化 | 放出a kJ | 吸收b kJ | 放出c kJ |
| SO2或SO3的转化率 | α1 | α2 | α3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
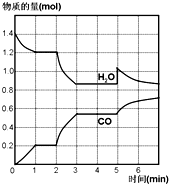 在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)?CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示:
在一容积为2L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)?CO(g)+H2(g),其中H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com