
分析 利用差量法,根据化学方程式分析:CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应:2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,总方程式为:2CO+2Na2O2=2Na2CO3,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应:2H2O+2Na2O2=4NaOH+O2,总方程式为:2H2+2Na2O2=4NaOH,质量增重△m=4NaOH-2Na2O2=2H2,可知反应后固体增加的质量为氢气质量.
解答 解:CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应:2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应:2CO2+2Na2O2=2Na2CO3+O2,总方程式为:2CO+2Na2O2=2Na2CO3,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;
2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应:2H2O+2Na2O2=4NaOH+O2,总方程式为:2H2+2Na2O2=4NaOH,质量增重△m=4NaOH-2Na2O2=2H2,可知反应后固体增加的质量为氢气质量;所以Na2O2增重的质量为CO与H2混合气体的质量,共3g,
故答案为:3.
点评 本题考查混合物的计算,难度中等,注意从CO2、H2O与Na2O2生成固体质量的变化分析规律,是解答该题的关键.


科目:高中化学 来源: 题型:选择题
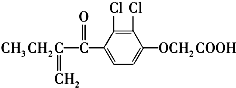 利尿酸是奥运会上被禁用的兴奋剂之一,其结构简式如下:
利尿酸是奥运会上被禁用的兴奋剂之一,其结构简式如下:| A. | 利尿酸分子内处于同一平面的原子数不超过10个 | |
| B. | 利尿酸的衍生物利尿酸甲酯的分子式是C14H14Cl2O4 | |
| C. | 该有机物有4种官能团 | |
| D. | 利尿酸能与FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
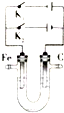 铁及其化合物是一类重要的物质,在人类的生产和生活中具有广泛的用途.
铁及其化合物是一类重要的物质,在人类的生产和生活中具有广泛的用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56g铁粉在1mol氯气中充分燃烧,失去的电子数为3NA | |
| B. | 1mol 固体Na2O2含有的阴阳离子总数为3NA | |
| C. | 等体积、浓度均为1mol/L的磷酸和盐酸,电离出的氢离子数之比为3:1 | |
| D. | 1L 1 mol•L-1的NaClO 溶液中含有ClO-的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 CCH3CH2OHD
CCH3CH2OHD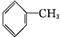 ECH3COOH
ECH3COOH
 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热反应在一定条件下也能发生 | |
| B. | 放热的反应在常温下一定很易发生 | |
| C. | 反应是吸热还是放热必须看反应物和生成物具有的总质量的相对大小 | |
| D. | 需加热方能发生的反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下1molO2与其他物质发生反应时转移的电子数一定为4NA | |
| B. | 1L 0.1 mol/L的Na2CO3溶液中,Na+、CO32-总数为0.3 NA | |
| C. | 28g C18O中含有的质子数为14 NA | |
| D. | 锌与一定浓度的浓硫酸反应,产生标准状况下SO2和H2的混合气体22.4L,锌失去电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2、H2均为0.18mol/L | B. | N2为0.15mol/L | ||
| C. | N2为0.2mol/L,H2为0.6mol/L | D. | NH3为0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
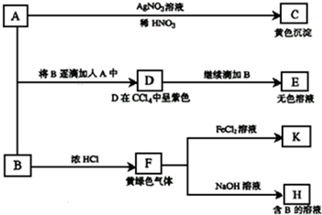
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com