
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,能被酸性高锰酸钾溶液氧化 | |
| B. | 该分子最少有4个碳原子共平面 | |
| C. | 常温下,能在碱性条件下发生水解反应 | |
| D. | 常温下,能够与碳酸钠溶液反应生成CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
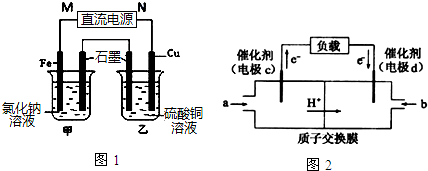
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某药物的结构式如图所示,使其与含1.2g NaOH的溶液反应完全,消耗该药物的质量为( )
某药物的结构式如图所示,使其与含1.2g NaOH的溶液反应完全,消耗该药物的质量为( )| A. | 2.19n g | B. | 2.19g | C. | $\frac{2.92}{n}$g | D. | 2.92g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
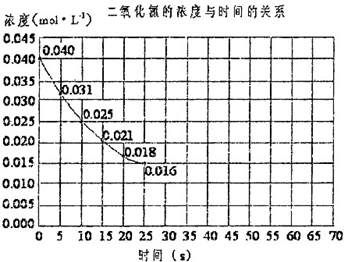
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
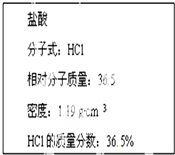 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com