
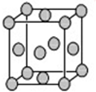
 ij��λ������Ϊ����ɫ���壬��ԭ���������������A��B��C��D��E����Ԫ����ɣ���ԭ�Ӹ�����Ϊl4��4��5��1��1�� ����C��DԪ��ͬ������ԭ������DΪC�Ķ�����EԪ�ص���Χ�����Ų�Ϊ��n-l��dn+6ns1���ش��������⣮
ij��λ������Ϊ����ɫ���壬��ԭ���������������A��B��C��D��E����Ԫ����ɣ���ԭ�Ӹ�����Ϊl4��4��5��1��1�� ����C��DԪ��ͬ������ԭ������DΪC�Ķ�����EԪ�ص���Χ�����Ų�Ϊ��n-l��dn+6ns1���ش��������⣮ �������Eԭ�ӵĺ�����29 �ֲ�ͬ�˶�״̬�ĵ��ӣ�B��C�ĵ�һ�����ܴ�С��ϵN��O ����Ԫ�ط��ű�ʾ����
�������Eԭ�ӵĺ�����29 �ֲ�ͬ�˶�״̬�ĵ��ӣ�B��C�ĵ�һ�����ܴ�С��ϵN��O ����Ԫ�ط��ű�ʾ����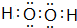 �����ֻ����������Ȼ��ܣ���������Ҫԭ��ΪH2O��H2O2֮���γ������
�����ֻ����������Ȼ��ܣ���������Ҫԭ��ΪH2O��H2O2֮���γ������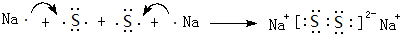 ��
������ ij��λ������Ϊ����ɫ���壬��ԭ���������������A��B��C��D��E����Ԫ�ع��ɣ���ԭ�Ӹ�����Ϊ14��4��5��1��1������C��DԪ��ͬ������ԭ������DΪC�Ķ�������CΪOԪ�ء�DΪSԪ�أ�EԪ�ص���Χ�����Ų�Ϊ��n-l��dn+6ns1����n+6=10����n=4��������Χ�����Ų�Ϊ3d104s1����EΪCu���ʸ�����ɫ����Ӧ����[Cu��NH3��4]2+��SO42-�����ԭ��������֪AΪH��BΪN����ԭ����Ŀ֮�ȣ���֪������ﺬ��1���ᾧˮ�����仯ѧʽΪ��[Cu��NH3��4]SO4•H2O���ݴ˽��
��� �⣺ij��λ������Ϊ����ɫ���壬��ԭ���������������A��B��C��D��E����Ԫ�ع��ɣ���ԭ�Ӹ�����Ϊ14��4��5��1��1������C��DԪ��ͬ������ԭ������DΪC�Ķ�������CΪOԪ�ء�DΪSԪ�أ�EԪ�ص���Χ�����Ų�Ϊ��n-l��dn+6ns1����n+6=10����n=4��������Χ�����Ų�Ϊ3d104s1����EΪCu���ʸ�����ɫ����Ӧ����[Cu��NH3��4]2+��SO42-�����ԭ��������֪AΪH��BΪN����ԭ����Ŀ֮�ȣ���֪������ﺬ��1���ᾧˮ�����仯ѧʽΪ��[Cu��NH3��4]SO4•H2O��
��1��DΪSԪ�أ��������ڱ��е������ڢ�A�壬BΪNԪ�أ�ԭ�ӵ���Χ�����Ų�ͼΪ ��EΪCu��ԭ�Ӻ�����29�����ӣ���ԭ�ӵĺ�����29�ֲ�ͬ�˶�״̬�ĵ��ӣ�NԪ��ԭ��2p���Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�أ��ʵ�һ������N��O��
��EΪCu��ԭ�Ӻ�����29�����ӣ���ԭ�ӵĺ�����29�ֲ�ͬ�˶�״̬�ĵ��ӣ�NԪ��ԭ��2p���Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�أ��ʵ�һ������N��O��
�ʴ�Ϊ���������ڢ�A�壻 ��N��O��
��N��O��
��2��CԪ�ؿ���AԪ���γ����ֳ����Ļ������ԭ�Ӹ����ȷֱ�Ϊ1��1��l��2���ֱ�ΪH2O��H2O2��H2O2�ĵ���ʽΪ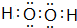 ������H2O��H2O2֮���γ���������ֻ����������Ȼ��ܣ�
������H2O��H2O2֮���γ���������ֻ����������Ȼ��ܣ�
�ʴ�Ϊ��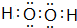 ��H2O��H2O2֮���γ������
��H2O��H2O2֮���γ������
��3��������������֪������λ������Ļ�ѧʽΪ��[Cu��NH3��4]SO4•H2O��
�ʴ�Ϊ��[Cu��NH3��4]SO4•H2O��
��4��AԪ����BԪ�ؿ��γɷ���ʽΪH2N2�Ļ�����û�����ķ��Ӿ���ƽ��ṹ��Ӧ����N=N˫��������ṹʽΪ��H-N=N-H��Na2S2��Na2O2�Ľṹ���ƣ��õ���ʽ��ʾ������Na2S2���γɹ���Ϊ��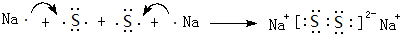 ��
��
�ʴ�Ϊ��H-N=N-H�� ��
��
��5��������Cuԭ����Ŀ=8��$\frac{1}{8}$+6��$\frac{1}{2}$=4���ʾ�������=$\frac{4��64}{{N}_{A}}$g����֪�����߳�Ϊa cm����Cu���ܶ�=$\frac{4��64}{{N}_{A}}$g�£�a cm��3=��g/cm3����NA=$\frac{256}{��{a}^{3}}$��
�Զ���ԭ���о�����֮���ڵ�ԭ�Ӵ������ģ�ÿ������Ϊ8���������У�ÿ������Ϊ2���������ã���Cuԭ����λ��Ϊ$\frac{8��3}{2}$=12��
CuSO4�������Һ������SO42-��Sԭ�Ӽ۲���Ӷ���=4+$\frac{6+2-2��4}{2}$=4��Sԭ�Ӳ����¶Ե��ӣ�����Ϊ�������幹�ͣ�Sԭ�Ӳ�ȡsp3�ӻ���
���CuSO4��Һ�ܷ�Ӧ����ʽΪ��2CuSO4+2H2O$\frac{\underline{\;���\;}}{\;}$2Cu+O2��+2H2SO4��
�ʴ�Ϊ��$\frac{256}{��{a}^{3}}$��12���������壻sp3�ӻ���2CuSO4+2H2O$\frac{\underline{\;���\;}}{\;}$2Cu+O2��+2H2SO4��
���� �����Ƕ����ʽṹ�Ŀ��飬�漰Ԫ�ػ������ƶϡ���������Ų�������ʽ��������������жϡ��ӻ�������������㡢����֪ʶ�㣬�ؼ��Ǹ�����λ������Ϊ����ɫ��������ƶϣ������õ���ʽ��ʾ���ʻ�ѧ�����γɣ����վ�̯�����о����йؼ��㣬�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0�� |
| 2 | �� | �� | �� | |||||
| 3 | �� | �� | �� | �� | �� | |||
| 4 | �� |
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
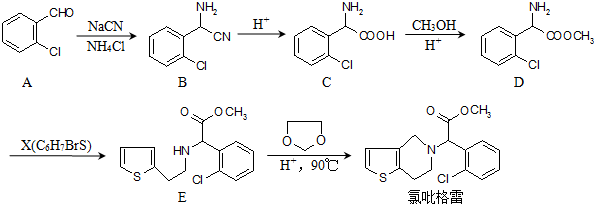
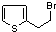 ��
�� ��
��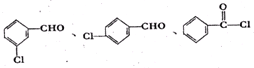 ��
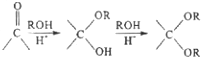
��
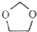 �ĺϳ�·��ͼ�����Լ���ѡ��
�ĺϳ�·��ͼ�����Լ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
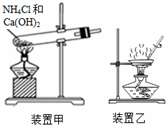
| A�� | Һ��Ӧʢ������ˮ�ܷ����ò�������������ɫ�Լ�ƿ�� | |
| B�� | ��ʪ��ĺ�ɫʯ����ֽ������������ | |
| C�� | ��װ�ü��Ʊ����� | |
| D�� | ��װ���Ҽ��ȷֽ�Al��OH��3���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
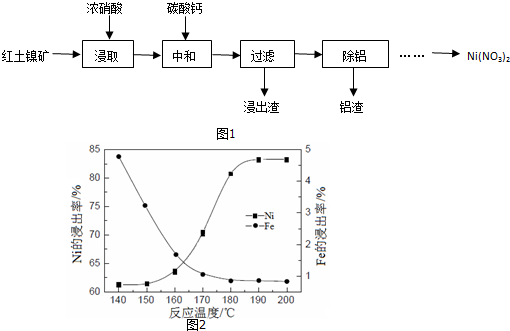
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 3g H2 | B�� | 11.2L HCl | C�� | 1.12L H2O | D�� | 3.01��1023��CH4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | I-131��${\;}_{53}^{77}$I | B�� | Cl-�Ľṹʾ��ͼ��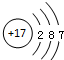 | ||
| C�� | ��Ȳ�Ľṹ��ʽ��CHCH | D�� | Na2S�ĵ���ʽ��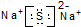 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
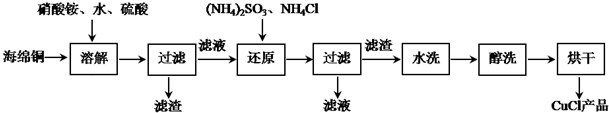
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com