
分析 (1)根据酸碱盐、电解质、非电解质的定义进行判断,酸是指电离出的阳离子全部是氢离子的化合物,碱是指电离出的阴离子全部是氢氧根离子的化合物,盐是指能电离出金属离子(或铵根离子)和酸根离子的化合物,在溶于水或熔融状态下能导电的化合物是电解质,在溶于水和熔融状态下都不能导电的化合物是非电解质;
(2)物质在水溶液中的电离方程式和电解质的强弱有关,强电解质完全电离,弱电解质不能完全电离.
解答 解:(1)①:酸是指电离出的阳离子全部是氢离子的化合物,故⑦H2SO4符合;碱是指电离出的阴离子全部是氢氧根离子的化合物,故④Cu(OH)2符合;
盐是指能电离出金属离子(或铵根离子)和酸根离子的化合物,故⑤MgCl2⑥NH4Cl符合,故答案为:⑦;④;⑤⑥;
②:在溶于水或熔融状态下能导电的化合物是电解质,③Na2O ④Cu(OH)2 ⑤MgCl2⑥NH4Cl ⑦H2SO4符合;在溶于水和熔融状态下都不能导电的化合物是非电解质,②CO2 ⑧C2H5OH(酒精)符合,
故答案为:③④⑤⑥⑦;②⑧.
(2)①硫酸氢钠是强电解质,在水溶液中完全电离,电离方程式如下:NaHSO4=Na++H++SO42-;故答案为:NaHSO4=Na++H++SO42-;
②碳酸氢钠是强电解质,在水溶液中完全电离,电离方程式如下:NaHCO3=Na++HCO3-;故答案为:NaHCO3=Na++HCO3-;
③硫酸铝是强电解质,在水溶液中完全电离,电离方程式如下:Al2(SO4)3=2Al3++2SO42-,故答案为:Al2(SO4)3=2Al3++2SO42-.
点评 本题考查了物质的分类问题,需根据酸、碱、盐、电解质、非电解质的定义及分类依据进行判断,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
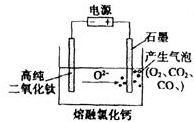 如图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛.阴极的电极反应式为TiO2+4e-→Ti+2O2-,石墨电极的质量是否发生变化是 (填“是”或“否”).
如图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛.阴极的电极反应式为TiO2+4e-→Ti+2O2-,石墨电极的质量是否发生变化是 (填“是”或“否”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量10.56gNa2CO3固体--用托盘天平 | |
| B. | 准确量取10.00mL的溶液--用50mL量筒 | |
| C. | 灼烧干海带至完全变成灰烬--用蒸发皿 | |
| D. | 过滤煮沸后的硬水--用普通漏斗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量浓度的HA溶液与MOH溶液等体积混合:c(H+)+c(M+)=c(OH-)+c(A-) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(CH3COONa)<c(Na2CO3)<c(NaOH) | |
| C. | c(CH3COOH)=c(CH3COONa)溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) | |
| D. | 0.1 mol•L-1的NaHCO3溶液:c(Na+)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com