
用惰性电极电解一定量的Cu(NO3)2溶液,下列说法中正确的是( )
A.阳极发生的电极反应为Cu2++2e-====Cu
B.阴极发生的电极反应为4OH--4e―====2H2O+O2↑
C.若有6.4 g金属Cu析出,放出的O2一定为0.05 mol
D.电解完成后,加入一定量的Cu(OH)2,溶液可能恢复到原来的浓度
科目:高中化学 来源: 题型:
某化学研究性学习小组为了模拟工业流程从浓缩的海水中提取液溴,查阅资料知:Br2的沸点为59℃,微溶于水,有毒性。设计了如下操作步骤及主要实验装置(夹持装置略去):
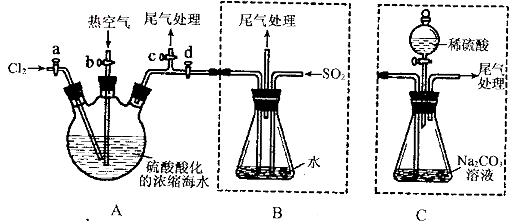
①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③进行步骤②的同时,向B中通入足量SO2:
④关闭b,打开a,再通过A向B中缓慢通入足量Cl2;
⑤将B中所得液体进行蒸馏,收集液溴。
请回答:
(1)实验室中常用来制备氯气的化学方程式为__________________________;
(2)步骤②中鼓入热空气的作用为_____________________________;
(3)步骤B中发生的主要反应的离子方程式为______________________________。
(4)此实验中尾气可用 (填选项字母)吸收处理。
a.水 b.浓硫酸 c.NaOH溶液 d.饱和NaCI溶液
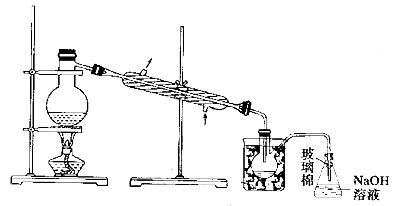
(5)步骤⑤中,用下图所示装置进行蒸馏,收集液溴,将装置图中缺少的必要仪器补画出来。
(6)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中滴加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,C中反应生成了NaBrO3等,该反应的化学方程式为____________。
(7)与B装置相比,采用C装置的优点为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某探究活动小组想利用原电池反应检测金属的活动性顺序,有甲、乙两位同学均使用镁片与铝片作电极,但甲同学将电极放入6 mol·L-1的稀H2SO4中,乙同学将电极放入6
mol·L-1的NaOH溶液中,如图所示。
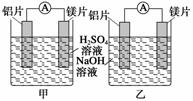
(1)写出甲池中发生的有关电极反应的反应式:
负极_______________________________________________________________,
正极_______________________________________________________________。
(2)写出乙池中发生的有关电极反应的反应式:
负极________________________________________________________________,
正极________________________________________________________________。
总反应离子方程式为__________________________________________________。
(3)如果甲与乙两位同学均认为“构成原电池的电极材料若是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强(填写元素符号)。
(4)由此实验,可得到如下哪些结论?________。
A.利用原电池反应判断金属活动性顺序应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,已没有实用价值
D.该实验说明化学研究对象复杂、反应条件多变,应具体问题具体分析
查看答案和解析>>
科目:高中化学 来源: 题型:
煤燃烧的反应热可通过以下两个途径来利用:
a.利用煤在充足的空气中直接燃烧产生的反应热;
b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为
a.C(s)+O2(g)====CO2(g) ΔH=E1 ①
b.C(s)+H2O(g)====CO(g)+H2(g) ΔH=E2 ②
H2(g)+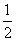 O2(g)====H2O(g) ΔH=E3 ③
O2(g)====H2O(g) ΔH=E3 ③
CO(g)+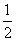 O2(g)====CO2(g) ΔH=E4 ④
O2(g)====CO2(g) ΔH=E4 ④
回答下列问题:
(1)与途径a相比途径b有较多的优点,即____________________________。
(2)上述四个热化学方程式中的反应__________________中ΔH>0。
(3)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是____________。
A.a比b多 B.a比b少 C.a与b在理论上相同
(4)根据能量守恒定律,E1、E2、E3、E4之间的关系为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能用化学平衡移动原理解释的是( )
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B.合成氨反应为提高氨的产率,理论上应采取降低温度的措施
C.反应CO(g)+NO2(g) CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D.对于2HI(g) H2(g)+I2(g),达平衡后缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后缩小容器体积可使体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
光气(COCl2)在塑料、制革、制药 等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为____________________________;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2和CO的燃烧热(ΔH)分别为-890.3 kJ·mol-1、-285.8 kJ·mol-1和
-283.0 kJ·mol-1,则生成1 m3(标准状况)CO所需热量为______________;
(3)COCl2的分解反应为COCl2(g)====Cl2(g)+CO(g) ΔH=+108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10 min到14 min的COCl2浓度变化曲线未表示出):
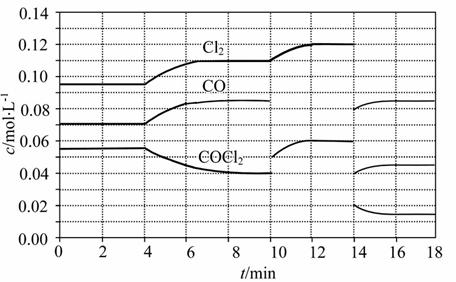
①计算反应在第8 min时的平衡常数K=__________;
②比较第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2)_____
T(8)(填“<”“>”或“=”);
③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=________
___ mol·L-1;
④比较反应物COCl2在5 min~6 min和15 min~16 min时平均反应速率的大小:v(5~6)_____v(15~16)(填“<”“>”或“=”),原因是______________
_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
碘与氢气反应的热化学方程式如下:
①I2(g)+H2(g)2HI(g) ΔH=-9.48 kJ·mol-1
②I2(s)+H2(g)2HI(g) ΔH=+26.48 kJ·mol-1
下列判断正确的是( )
A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应①的产物比反应②的产物稳定
D.反应②的反应物总能量比反应①的反应物总能量低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com