
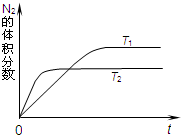
| C2(NO) |
| C(N2)C(O2) |
| ||||
|
| 1 |
| 9 |
| ||||
|
| 1 |
| 9 |
| 1 |
| 7 |
| ||
| 1mol |
| 1 |
| 9 |
| 1 |
| 7 |


科目:高中化学 来源: 题型:
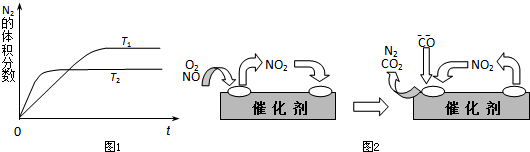
| 1 |
| 9 |
| 1 |
| 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
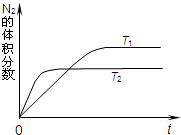 汽车内燃机工作时产生的高温会引起N2和O2发生反应生成NO气体,是导致汽车尾气中含有NO的原因之一.
汽车内燃机工作时产生的高温会引起N2和O2发生反应生成NO气体,是导致汽车尾气中含有NO的原因之一.| 1 |
| 9 |
| 1 |
| 9 |
| 1 |
| 7 |
| 1 |
| 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 汽车内燃机工作时产生的高温会引起N2和O2的反应:N2(g)+O2(g)
汽车内燃机工作时产生的高温会引起N2和O2的反应:N2(g)+O2(g)![]() 2NO(g),是导致汽车尾气中含有NO的原因之一。某同学为控制污染,对该反应进行研究。
2NO(g),是导致汽车尾气中含有NO的原因之一。某同学为控制污染,对该反应进行研究。
⑴右图表示在T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图像,根据图像判断反应N2(g)+O2(g)![]() 2NO(g)为 (填“吸热”或“放热”)反应。
2NO(g)为 (填“吸热”或“放热”)反应。
⑵2000℃时,向容积为2L的密闭容器中充入10molN2与5mol O2,达到平衡后NO的物质的量为2mol,则2000℃时该反应的平衡常数K= 。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为 。
⑶为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。
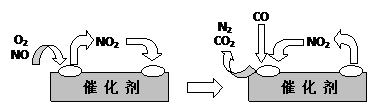
写出上述变化中的总化学反应方程式: 。
查看答案和解析>>
科目:高中化学 来源:2011-2012年安徽芜湖一中高二下学期期中考试理科化学试卷(解析版) 题型:填空题
汽车内燃机工作时产生的高温会引起N2和O2发生反应:N2(g)+O2(g) 2NO(g),这是汽车尾气中含有NO的原因之一。某同学为探究控制污染的方法,对该反应进行研究。
2NO(g),这是汽车尾气中含有NO的原因之一。某同学为探究控制污染的方法,对该反应进行研究。
(1)如图表示在T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图象。
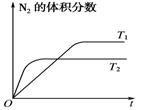
①达到平衡后反应速率v1(T1条件下)________v2(T2条件下)(填“>”、“<”或“=”)。
②N2(g)+O2(g) 2NO(g)为________(填“吸热”或“放热”)反应。
2NO(g)为________(填“吸热”或“放热”)反应。
(2)为避免汽车尾气中的有害气体对大气造成污染,应给汽车安装尾气净化装置。净化装置里装有含Pd等过渡元素的催化剂,写出CO、NO在催化剂作用下转化为无害气体的化学方程式:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com