
 中和热概念:酸与碱发生中和反应生成1mol H2O时释放的热量.已知
中和热概念:酸与碱发生中和反应生成1mol H2O时释放的热量.已知 

 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:

| A、维生素A的分子式为C20H30O |
| B、维生素A是一种易溶于水的醇 |
| C、维生素A分子中含有羟基、碳碳双键和苯环等官能团 |
| D、1mol维生素A最多可与7mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
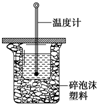 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)某温度下,在2L密闭容器中,3种气态物质 X、Y、Z的物质的量随时间变化曲线如图.
(1)某温度下,在2L密闭容器中,3种气态物质 X、Y、Z的物质的量随时间变化曲线如图.| 实验 序号 |
浓度时间 温度 (℃) |
0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50[ | 0.50 |
| 2 | 800 | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800 | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com