
| A. | -167℃ | B. | -87℃ | C. | -35℃ | D. | 50℃ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 目的 | 古代文献 | 说明 | |
| A | 使用 | 《周礼》:“煤饼烧蛎房(牡蛎壳)成灰”,蔡伦造纸用此“灰”溶于水沤浸树皮脱胶. | “灰”的主要成分是氧化钙 |
| B | 鉴别 | 《新修本草》:硝石“如握盐雪不冰,强烧之,紫青烟起”,用于区分硝石(KNO3)和朴硝(Na2SO4) | 利用颜色反应 |
| C | 浸出 | 《肘后备急方》:“青蒿一握,以水二升渍,绞取汁,尽服之”. | 提取青蒿素中的纤维素 |
| D | 性质 | 《本草纲目》:“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧机诸药者”. | 利用KNO3的氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下同浓度的强酸、强碱等体积混合后由水电离出的c(H+)═10-7mol•L-l | |
| B. | 常温下pH=2的盐酸和pH=12的氨水等体积混合后c(C1-)+c(H+)═c(NH4+)+c(OH-) | |
| C. | 常温下0.1 mol•L-1的Na2A溶液的pH=10,则该溶液中由水电离的c(OH-)=10 -10 mol•L-l | |
| D. | 常温下向10 mL0.1 mol•L-1的CH3 COOH溶液中滴加相同浓度的氨水,在滴加过程中,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 装置 | 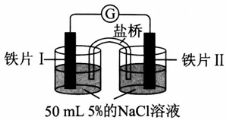 | 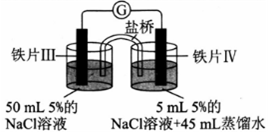 |
| 现象 | 电流计指针未发生偏转 | 电流计指针偏转 |
| A. | 加热铁片I所在烧杯,电流表指针会发生偏转 | |
| B. | 用KSCN溶液检验铁片Ⅲ、IV附近溶液,可判断电池的正、负极 | |
| C. | 铁片I、Ⅲ的腐蚀速率相等 | |
| D. | “电流计指针未发生偏转”,说明铁片I、铁片Ⅱ均未被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
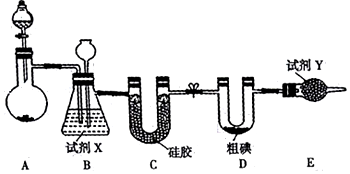
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应2H2(g)+O2(g)═2H2O(l) 在室温下可自发进行,则该反应的△H<0 | |
| B. | 常温常压下,7.8gNa2O2与水完全反应,产生1.12L气体 | |
| C. | 煤的干馏是物理变化,石油的裂化是化学变化 | |
| D. | 气体分子总数不再改变时,反应H2(g)+I2(g)?2HI(g))达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
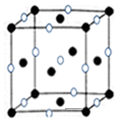 已知A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大.A的基态原子2p能级有2个单电子;C占整个地壳质量的48.6%,是地壳中含量最多的元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性;F位于ds区,最外能层有单电子,是唯一的能大量天然产出的金属;D与F不同周期,但最外能层电子数相等.
已知A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大.A的基态原子2p能级有2个单电子;C占整个地壳质量的48.6%,是地壳中含量最多的元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性;F位于ds区,最外能层有单电子,是唯一的能大量天然产出的金属;D与F不同周期,但最外能层电子数相等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
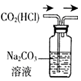 | 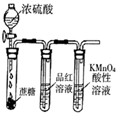 | 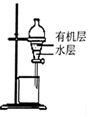 | 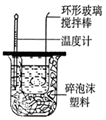 |
| 除去CO2中含有的少量HCl气体 | 说明浓H2SO4具有脱水性,强氧化性,SO2具有漂白性、还原性 | 将有机层从分液漏斗下口放出 | 用于中和反应反应热的测定 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com