
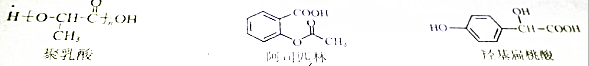
| A. | 三种有机物都能发生酯化反应 | |
| B. | 聚乳酸分子中存在酯基、羧基、羟基 | |
| C. | 羟基扁桃酸在浓硫酸作用下能生成含三个六元环结构的有机物 | |
| D. | 等物质的量的阿司匹林与羟基扁桃酸能消耗的NaOH的量相等 |
分析 A.含有羟基、羧基可发生酯化反应;
B.乳酸发生缩聚反应生成聚乳酸,含有酯基以及端基原子或原子团;
C.羟基扁桃酸含有羟基和羧基,可发生酯化反应生成环酯;
D.阿司匹林含有羧基和酯基,且酯基可水解生成酚羟基,羟基扁桃酸含有酚羟基和羧基.
解答 解:A.聚乳酸含有羟基、羧基,阿司匹林含有羧基,羟基扁桃酸含有羟基和羧基,可发生酯化反应,故A正确;
B.乳酸发生缩聚反应生成聚乳酸,含有酯基以及端基原子或原子团,则含有羟基、羧基,故B正确;
C.羟基扁桃酸含有羟基和羧基,两分子羟基扁桃酸发生酯化反应生成环酯,生成的环酯中含有两个苯环、一个酯环,共3个环,故C正确;
D.阿司匹林含有羧基和酯基,且酯基可水解生成酚羟基,羟基扁桃酸含有酚羟基和羧基,则二者消耗的氢氧化钠的物质的量之别为3:2,不相等,故D错误.
故选D.
点评 本题考查有机物的结构和性质,为高考常见题型,侧重于学生的分析能力的考查,本题注意把握有机物官能团的性质,难度中等.


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
 ③CH3OH ④CH3Cl ⑤CCl4⑥HCOOCH3 ⑦CH3COOCH2CH3 ⑧CH3COOH按官能团的不同可分为( )
③CH3OH ④CH3Cl ⑤CCl4⑥HCOOCH3 ⑦CH3COOCH2CH3 ⑧CH3COOH按官能团的不同可分为( )| A. | 4类 | B. | 5类 | C. | 6类 | D. | 8类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
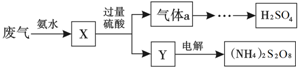
| A. | X可能含有2种盐 | |
| B. | 气体a通入双氧水,可实现“绿色”转化 | |
| C. | Y主要含有(NH4) 2SO4,回收利用作化肥 | |
| D. | (NH4) 2S2O8中S的化合价为+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
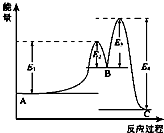 某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )| A. | 两步反应均为吸热反应 | B. | 加入催化剂会改变反应的焓变 | ||
| C. | 三种化合物中C最稳定 | D. | 整个反应中△H=E1-E4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
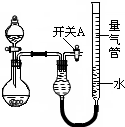 某同学设计如图所示装置分别进行探究实验(夹持装置已略去)
某同学设计如图所示装置分别进行探究实验(夹持装置已略去)| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| ① | Cu、稀HNO3 | H2O | |
| ② | NaOH固体、浓氨水 | NH3 | |
| ③ | Na2CO3固体、稀H2SO4 | CO2 | |
| ④ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| 1 | 1.0g | 10.0mL | 347.5mL |
| 2 | 1.0g | 10.0mL | 335.0mL |
| 3 | 1.0g | 10.0mL | 344.5mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
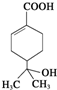
| A. | 分子中含有两种官能团 | |
| B. | 可使溴水和酸性高锰酸钾溶液褪色,且原理相同 | |
| C. | 能发生加成、取代、氧化、消去等反应 | |
| D. | 与钠和氢氧化钠溶液都能发生反应,且得到的产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第三次月考模拟化学试卷 题型:选择题
如下图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O。下列说法正确的是

A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化为电能的装置
B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=CO32-+8H+
C.反应一段时间后.向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
D.甲池中消耗280mL(标准伏况下)O2,此时丙池中理论上最多产生1.45g固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com