
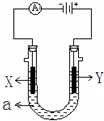
 如图表示一个电解池,装有电解液a、X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a、X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:分析 (1)电解饱和食盐水时,阳极上是氯离子失电子,阴极上是氢离子得电子,氯气与硫化钠反应生成单质硫,所以现象为溶液中产生黄色沉淀产生;
(2)要镀一定厚度的Ag,所以银离子在阴极放电生成单质银,阳极氢氧根离子放电,生成氧气;
(3)根据氯气的物质的量计算出计算的物质的量,再计算出金属的摩尔质量.
解答 解:(1)和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,所以该电极附近氢氧根浓度增大,碱性增强,滴入几滴酚酞试液会变红,Y电极与电源的正极相连,所以Y是阳极发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑,氯气与硫化钠反应生成单质硫,所以现象为溶液中产生黄色沉淀产生,电解NaCl溶液的离子方程式是:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH-,2.925×105 g食盐的物质的量为$\frac{2.925×1{0}^{5}}{58.5}$=5×103mol,所以产生氯气和氢气的物质的量均为:$\frac{5×1{0}^{3}×50}{2}$=1.25×105 mol,Cl2与H2按体积比1:1.15通入合成塔,所以通入合成塔的H2为1×105mol,Cl2为1×105mol,则生成氯化氢的物质的量为:2×105mol,所以质量为73×105g,所以理论上一天可生产36.5%的盐酸质量为20t,
故答案为:有无色气泡产生,溶液变红; 2Cl--2e-=Cl2↑;溶液中产生黄色沉淀产生; 2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH-;20;
(2)要镀一定厚度的Ag,所以银离子在阴极放电生成单质银,所以电极反应式为:Ag++e-=Ag;阳极氢氧根离子放电,生成氧气,氢氧根离子的浓度减小,所以工作一段时间后pH将减小,故答案为:Ag++e-=Ag;减小;
(3)氯气的物质的量为:n(Cl2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,则n(X2+)=0.05mol,金属的摩尔质量为:M=$\frac{m}{n}$=$\frac{3.2g}{0.05mol}$=64g/mol,故答案为:64.
点评 本题考查学生电解池的工作原理知识,为实验探究综合题,充分的展示了化学知识的方方面面,该题综合性强难度较大,对训练学生良好地思维品质以及知识的严密性有较好的帮助,明确图中电源的正负极确定电解池的阴阳极是解答的关键,并熟悉电极反应及离子的放电顺序来解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
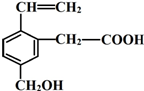 某有机物的结构简式如图,该物质可能有的化学性质是( )
某有机物的结构简式如图,该物质可能有的化学性质是( )| A. | ①②③⑥ | B. | ①②④⑤ | C. | ①②③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,4v正(O2)=5v逆(NO) | |
| B. | 若单位时间内生成x mol NO的同时,消耗x molNH3,则反应达到平衡 | |
| C. | 达到化学平衡时,若增加容器体积,则正 反应速率减少,逆反应速率增加 | |
| D. | 化学反应速率关系是2v正(NH3)=3v正(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若混合物为溴水,可通过方案Ⅰ进行分离,加入试剂为CCl4液体,充分振荡后液体分层,上层为X的CCl4溶液 | |
| B. | 若为苯和苯酚的混合物,可通过方案Ⅱ进行分离,加入试剂为浓溴水,X为苯 | |
| C. | 若为溴苯和溴的混合物,可通过方案Ⅰ进行分离,加入试剂为NaOH溶液,X为溴苯 | |
| D. | 若为己烷和己炔的混合物,可通过方案Ⅰ进行分离,加入试剂为溴水,X为己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用容量瓶前应先检查它是否漏水 | |
| B. | 容量瓶先用蒸馏水洗净,再用待配液润洗 | |
| C. | 配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到液面距刻度线1~2 cm处,再改用胶头滴管滴加蒸馏水至刻度线 | |
| D. | 浓硫酸稀释后马上转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 摩尔是把可称量物质与微观粒子联系起来的一个国际基本物理量 | |
| B. | 气体的摩尔体积与温度和压强有关,温度越高,体积越大 | |
| C. | 任何一种微观粒子,其摩尔质量以g/mol为单位,数值与这种粒子的相对分子质量或相对原子质量相同 | |
| D. | 若x个N(氮)原子的质量是1g,则阿伏加德罗常数可表示为14x mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com