
����Ŀ��ij��ѧ��ȤС��Լӵ�ʳ���е�KIO3�����о�������һ�ְ�ɫ��ĩ�������º��ȶ���������������KIO3��һ�ֽ�ǿ������������HI��H2O2�����ã�����ԭΪ�ⵥ�ʡ� ѧ�������ʵ�����ӵ�ʳ���е�Ԫ�صĺ������������£�
a����ȡmg�ӵ��Σ�����������ˮ�ܽ⣻
b����ϡ�����ữ���ټ������KI��Һ��������Ӧ��IO3��+5I��+6H+=3I2+3H2O������Ӧ�����Һ��ˮϡ����100.00 mL��
c��ȡ10.00mL������Һ����ƿ�У��Ե���Ϊָʾ���������ʵ���Ũ��Ϊ3.0molL��1�� Na2S2O3��Һ�ζ�(�ζ�ʱ�ķ�Ӧ����ʽ��I2+2S2O32���T2I��+S4O62��)��
d���ظ�ʵ��2�Σ�����ʵ��ֱ��¼�й��������£�
�ζ����� | ������Һ�����/mL | 1.00��10��3molL��1�� Na2S2O3��Һ�����(mL) | |
�ζ�ǰ�̶� | �ζ���̶� | ||
��һ�� | 10.00 | 2.62 | 22.60 |
�ڶ��� | 10.00 | 7.56 | 30.30 |
������ | 10.00 | 6.22 | 26.24 |
�Իش�
��1������ͼ����ij�εζ�ʱ�ĵζ����е�Һ�棬�����Ϊ___________mL��
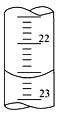
��2���жϵ���ζ��յ�������ǣ�_______________________��
��3���ζ�ʱ��Na2S2O3��ҺӦ����______________ (������ʽ�ζ�����������ʽ�ζ�����)��
��4������ʵ��ⶨ���ݣ�����ӵ�ʳ����Ʒ�еĵ�Ԫ�ذٷֺ�����_______(�Ժ�m�Ĵ���ʽ��ʾ)��
��5����������ʵ������мٶ������������,���²������Һ��Ũ����(����ƫС������ƫ����������Ӱ����)
�ٱ�Һ����ʱ�����ζ�ǰ���ӣ��ζ������ӣ��������Һ��Ũ��__________
��ʢ��Һ�ĵζ��ܣ��ζ�ǰ�ζ��ܼ�������ݣ��ζ���������ʧ���������Һ��Ũ��___
���𰸡�22.60mL ��Һ����ɫ����ɫ���Ұ�����ڲ��ָ� ��ʽ�ζ��� ![]() ƫ�� ƫ��
ƫ�� ƫ��
��������
(1)�����ݵζ��ܾ�ȷ��0.01mL������
(2)����������ˮ������жϣ�Na2S2O3Ϊǿ�������Σ�
(3)���ⵥ������������ɫ�����ⵥ��������ɫ��ȥ��
(4)�����ݷ�Ӧ�ҳ���Ӧ��ϵʽ��Ȼ������������ݼ�����ӵ�ʳ����Ʒ�еĵ�Ԫ�غ�����
(5)������ ������
������
(1)���ζ�����Һ�����Ϊ22.60mL��
�ʴ�Ϊ22.60mL��
(2)��b������I2 ��c��ʹ�õ�����Ϊָʾ�������������Һ����ɫ����Na2S2O3��Һ�ζ�, I2��Ӧ��ϣ���Һ��ɫ��ɫ���ζ��յ�����Ϊ����ɫ����ɫ���Ұ�����ڲ��ָ���
�ʴ�Ϊ��Һ��ɫ����ɫ���Ұ�����ڲ��ָ���
(3)��Na2S2O3Ϊǿ��������,��Ϊ������������ˮ�⣬Na2S2O3��Һ�������ԣ����Եζ�ʱNa2S2O3��ҺӦ���ڼ��Եζ����У�
�ʴ�Ϊ��ʽ�ζ��ܣ�
(4)�����ݱ����֪�����εζ����ĵ�Na2S2O3����ֱ�Ϊ��19.98mL��22.74mL��20.02mL���ڶ�������������ϴ�Ӧ��ȥ����������Na2S2O3��Һ���Ϊ20mL������Na2S2O3�����ʵ���Ϊ3.00mol/L��0.02L = 0.06mol ������IO3��+5I��+6H+=3I2+3H2O��I2+2S2O32���T2I��+S4O62������IO3��~3I2~6 S2O32��������10mL��Һ�е���ص����ʵ���Ϊ0.01mol����100ml��Һ�е����ʵ���Ϊ0.1mol����Ԫ�ص�����Ϊ��0.1mol��127g/mol=12.7g�����Լӵ�ʳ����Ʒ�еĵ�Ԫ�غ���Ϊ![]() ��
��
�ʴ�Ϊ![]() ��
��
(5) �١����ζ�ǰ������ҺҺ�棬�ζ�������Һ��̶ȣ���ȡ����Һ���ƫ���� ������֪�ⶨ���ƫ��
������֪�ⶨ���ƫ��
�ڡ�ʢ��Һ�ĵζ��ܣ��ζ�ǰ�ζ��ܼ�������ݣ��ζ���������ʧ������Һ���ƫ���� ������֪�������Һ��Ũ��ƫ��
������֪�������Һ��Ũ��ƫ��
�ʴ�Ϊƫ��ƫ��


 ��ѧʵ����ϵ�д�
��ѧʵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ƽ�ⳣ����˵����ȷ���ǣ� ��
A.��֪K=![]() �����Ӧ�Ļ�ѧ��Ӧ���Ա�ʾΪ��2CO2(g) + 6H2(g)
�����Ӧ�Ļ�ѧ��Ӧ���Ա�ʾΪ��2CO2(g) + 6H2(g)![]() CH3CH2OH(g)+3H2O(g)
CH3CH2OH(g)+3H2O(g)
B.��ѧƽ�ⳣ��K���¶��йأ����¶ȵ����ߣ�K��������Ҳ���ܼ�С
C.�����£���ˮ�м���̼���ƣ�ˮ�ĵ���̶ȱ��Kw���
D.��ijŨ���������Һ�����¶ȣ������ĵ���ƽ�ⳣ��Ka�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�ʾ��Һ�з�����Ӧ�Ļ�ѧ����ʽ�������
A. 2Al��2NaOH��2H2O��2NaAlO2��3H2��
B. KMnO4��HCOOK��KOH��2K2MnO4��CO2����H2O
C. MnO2��4HCl(Ũ)![]() MnCl2��Cl2����2H2O
MnCl2��Cl2����2H2O
D. K2Cr2O7��6FeSO4��7H2SO4��Cr2(SO4)3��3Fe2(SO4)3��K2SO4��7H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ���й����ʵĵ���ƽ�ⳣ�����£�
��ѧʽ | CH3COOH | H2CO3 | H2SO3 |
����ƽ�ⳣ��K | K=1.8��10-5 | K1=4.3��10-7 K2=5.6��10-11 | K1=1.5��10-2 K2=1.02��10-7 |
��1���������ֵ���ʵ�������ǿ����˳��Ϊ__________________(�û�ѧʽ��ʾ����ͬ)��
��2�������£�0.02 mol��L��1��CH3COOH��Һ�ĵ����ԼΪ______�����Ϊ10mLpH=2�Ĵ�����Һ����������Һ�ֱ������ˮϡ����1000mL��ϡ�ͺ���Һ��pH��ǰ��________����(������������=��)��
��3����֪NaHSO3��Һ�����ԣ���ԭ����____________(���ӷ���ʽ���ʵ���������)��
��4��H2SO3��Һ��NaHCO3��Һ��Ӧ����Ҫ���ӷ���ʽΪ_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A.��Ϊ��Ӧ��Ũ��Խ��Ӧ����Խ�죬���Գ����£���ͬ����Ƭ�зֱ����������Ũ���ᡢϡ�����У�Ũ��������Ƭ���ܽ���
B.����Ӧ��Ũ�ȿɼӿ췴Ӧ���ʣ������Ũ����������Ӧ����������H2������
C.N2(g)��3H2(g)![]() 2NH3(g)��H<0��������������ʱ�����¶ȣ���Ӧ����v(H2)��H2��ת���ʾ�����
2NH3(g)��H<0��������������ʱ�����¶ȣ���Ӧ����v(H2)��H2��ת���ʾ�����
D.���ڷ�Ӧ2H2O2===2H2O��O2��������MnO2�������¶ȶ��ܼӿ�O2����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ȣ�ClO2����һ����ˮ�����ȷ����й㷺Ӧ�õĸ�Ч��ȫ����������Cl2�ȣ�ClO2�������и�������ɱ�����������Ҳ��������������DZ��Σ�����л��ȴ��
��1����ClO2���Ʊ������У������������Ʊ�������
����һ��2NaClO3��4HCl��2ClO2����Cl2����2NaCl��2H2O
������2NaClO3��H2O2��H2SO4��2ClO2����Na2SO4��O2����2H2O��
�÷������Ʊ���ClO2���ʺ���������ˮ������������Ҫԭ����_______________��
��2����ClO2������������ˮ��pHΪ5.5~6.5��������һ���������岻���������������
��ClO2������2001���ҹ��������涨������ˮ��ClO2���ĺ���Ӧ������0.2mg��L��1��
����ˮ��ClO2��ClO2���ĺ��������������������вⶨ��ClO2��I����ԭΪClO2����Cl����ת��������ҺpH�Ĺ�ϵ��ͼ��ʾ��

��pH��2.0ʱ��ClO2��Ҳ�ܱ�I����ԭ��Cl����
��Ӧ���ɵ�I2�ñ�Na2S2O3��Һ�ζ��� Na2S2O3��I2��Na2S4O6��2NaI
����д��pH��2.0ʱ��ClO2����I����Ӧ�����ӷ���ʽ______________________��
���������Ӧ��ʵ�鲽�裺
����1��ȷ��ȡVmLˮ�����뵽��ƿ�С�
����2������ˮ����pHΪ7.0~8.0��
����3������������KI���塣
����4����������������Һ����cmol��L��1Na2S2O3��Һ�ζ����յ㣬����Na2S2O3��ҺV1mL��
����5��______________________��
����6������cmol��L��1Na2S2O3��Һ�ζ����յ㣬����Na2S2O3��ҺV2mL��
�����������������ݣ���ø�����ˮ����ClO2��Ũ��Ϊ_____________mol��L��1�ú���ĸ�Ĵ���ʽ��ʾ��
��������ˮ��ClO2���ĺ������꣬�������м���������Fe2����ClO2����ԭ��Cl�����÷�Ӧ������������___________���ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ������ϵʾ��ͼ������˵����ȷ����
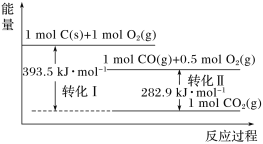
A. 1 mol C(s)��1 mol O2(g)������֮��Ϊ393.5 kJ
B. ��Ӧ2CO(g)��O2(g)= 2CO2(g)�У�����������������ڷ�Ӧ���������
C. ��C(s)��CO(g)���Ȼ�ѧ����ʽΪ��2C(s)��O2(g)= 2CO(g)����H����221.2 kJ��mol��1
D. ��ֵָһ�������µ�λ������������ȫȼ�����ų���������CO��ֵ��H����10.1 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������а��ֻ��ţ��ٱ�������ȩ�������ǻ������Ȼ������һ�������ԭ�ӣ�-Cl�����������Ȼ���������ϣ����γɻ����д���������������Ļ����
��1����������ԭ����������2�����������ԣ������ܺ�̼�����Ʒ�Ӧ_______________
��2��������ֻ��1����ԭ�ӣ��ܷ���������Ӧ�����ʣ�������ȩ�ͼ����ȣ�Cl-CHO����У�д���ƣ�__________��д�������л����������Ӧ�Ļ�ѧ����ʽ_________
��3��������ֻ��1����ԭ�ӣ����ܸ��������Ʒ�Ӧ�����ܹ�����������Ӧ���л��д���ƣ�________��д�������л������һ����Է�����������л����������Ӧ�Ļ�ѧ����ʽ______________.
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com