
| A. |  和 和 | B. | 丙烷和2,2一二甲基丙烷 | ||
| C. | 乙二醇和丙三醇 | D. | 1,1一二氯乙烷和1,2一二氯乙烷 |
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:填空题
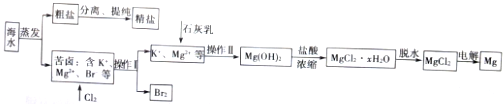
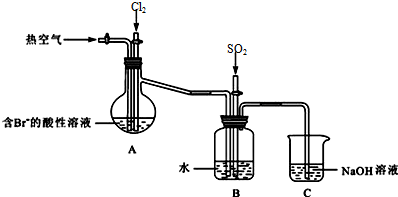
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丢弃的废电池不会造成污染 | |
| B. | 锌锰干电池负极锌在工作时失去电子 | |
| C. | 氢氧燃料电池是将热能直接转化为电能 | |
| D. | 二次电池的充电过程是将化学能转化成电能的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 发光二极管(LED)的材质基本以砷化镓、磷化铝镓铟(InGaAIP)、氮化铟镓(GaInN)为主.已知镓、砷分别是同族的铝、磷的下一周期元素.如图是砷化镓的晶胞结构图(白球为砷,黑球为镓).请回答:
发光二极管(LED)的材质基本以砷化镓、磷化铝镓铟(InGaAIP)、氮化铟镓(GaInN)为主.已知镓、砷分别是同族的铝、磷的下一周期元素.如图是砷化镓的晶胞结构图(白球为砷,黑球为镓).请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④ | C. | ①②③⑥ | D. | ③④⑤⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com