
| 7.8g |
| 78g/mol |
| 0.3mol |
| 0.1L |
| 0.06mol+0.01mol |
| 0.1L |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 已知元素A、B、C、D、E、F均属前四周期,且原子序数依次增大,A的p能级电子数是s能级电子数的一半,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能级层均排满,且最外层电子数为1.请回答下列问题:
已知元素A、B、C、D、E、F均属前四周期,且原子序数依次增大,A的p能级电子数是s能级电子数的一半,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能级层均排满,且最外层电子数为1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
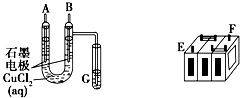 (Ⅰ)某铅蓄电池的正、负极标记被磨损.试用如图装置设计实验,识别出此铅蓄电池的正负极.
(Ⅰ)某铅蓄电池的正、负极标记被磨损.试用如图装置设计实验,识别出此铅蓄电池的正负极.查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 结构及性质 |
| A | A的原子半径最小 |
| X | X原子最外层电子数是次外层的两倍 |
| D | D是短周期中金属性最强的元素 |
| E | E的最高价氧化物对应水化物是一种常见的两性氢氧化物 |
| R | R与X同主族 |
| T | T的负一价阴离子的核外电子排布与Ar原子相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、推广使用无磷洗衣粉 |
| B、使用清洁燃料的公交车 |
| C、减少含硫化石燃料的大量燃烧 |
| D、使用不易降解的一次性塑料餐具 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、由X、Y、Z、M四种元素形成的化合物一定有共价键 |
| B、原子半径:W>Z>Y>X>M |
| C、由X元素形成的单质一定是原子晶体 |
| D、XZ2、X2M2、W2Z2均为直线型的共价化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com