
【题目】R、Q、X、Y、Z是原子序数依次增大的五种短周期元素,R与Q形成的气态化合物,在标准下的密度为0.76 g/L,X、Y、Z三种元素族序数之和为10,Y是地壳中含量最多的金属元素,Y单质能强碱溶液反应,Z元素原子最外层电子数是电子层数的两倍。
(1)X在周期表中的位置______________;X、Y、Z三种元素形成的简单离子半径由大到小的顺序是_____________________。(用离子符号回答)
(2)X和R两种元素按原子个数比1:1组成的化合物的电子式为___________,推测这种化合物具有较强的_________________。(填“氧化性”或“还原性”)
(3)写出Y、Z两种元素最高价氧化物对应的水化物相反应的离子方程式:____________。
(4)水的沸点远高于Z元素的氢化物的沸点,原因是_______________________________。
(5)Q4是一种Q元素的新单质,可用作推进剂或炸药,推算其分子中含有________________________对共用电子。
(6)由R、Q两元素组成的一种液态化合物W常用作还原剂,W分子中含有18个电子,W分子的结构式为____________________。W与氢氧化铜悬浊液反应生成氧化亚铜,同时产生一种稳定的气态单质,该反应的化学方程式为____________________________。
【答案】第三周期第IA族S2->Na+>Al3+![]() 还原性Al(OH)3 + 3H+ = Al3+ + 3H2O水分子之间形成氢键6
还原性Al(OH)3 + 3H+ = Al3+ + 3H2O水分子之间形成氢键6![]() 4Cu(OH)2 + N2H4 = 2Cu2O + N2↑ + 6H2O
4Cu(OH)2 + N2H4 = 2Cu2O + N2↑ + 6H2O
【解析】
R、Q、X、Y、Z是原子序数依次增大的五种短周期元素,R与Q形成的气态化合物在标准下的密度为0.76 g/L,则该气态化合物的相对分子质量=0.76×22.4=17,应为NH3,可推知R为H元素、Q为N元素;Y是地壳中含量最多的金属元素,且单质能强碱溶液反应,则Y为Al;Z的原子序数大于Al,处于第三周期,Z元素原子最外层电子数是电子层数的两倍,最外层电子数为6,故Z为S元素;X、Y、Z三种元素族序数之和为10,则X的族序数为10-3-6=1,故X为Na。
(1)X为Na,在周期表中的位置:第三周期第IA族;电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:S2->Na+>Al3+,
因此,本题正确答案是:第三周期第IA族;S2->Na+>Al3+;
(2)X和R两种元素按原子个数比1:1组成的化合物为NaH,电子式为 ![]() ,该化合物中H元素表现-1价,推测这种化合物具有较强的还原性,
,该化合物中H元素表现-1价,推测这种化合物具有较强的还原性,
因此,本题正确答案是:![]() ;还原性;
;还原性;
(3)Y、Z两种元素最高价氧化物对应的水化物分别为Al(OH)3、H2SO4,二者反应的离子方程式:Al(OH)3 + 3H+ = Al3+ + 3H2O,
因此,本题正确答案是:Al(OH)3 + 3H+ = Al3+ + 3H2O;
(4)水分子之间形成氢键,而硫化氢分子之间不能形成氢键,水的沸点远高于硫氢化的沸点,
因此,本题正确答案是:水分子之间形成氢键;
(5)N4是一种氮元素的新单质,为正四面体结构,其分子中含有6对共用电子,
因此,本题正确答案是:6;
(6)由R、Q两元素组成的一种液态化合物W常用作还原剂,W分子中含有18个电子,则W为N2H4,W分子的结构式为 ![]() ,W与氢氧化铜悬浊液反应生成氧化亚铜,同时产生一种稳定的气态单质为氮气,该反应的化学方程式为:4Cu(OH)2 + N2H4 = 2Cu2O + N2↑ + 6H2O,
,W与氢氧化铜悬浊液反应生成氧化亚铜,同时产生一种稳定的气态单质为氮气,该反应的化学方程式为:4Cu(OH)2 + N2H4 = 2Cu2O + N2↑ + 6H2O,
因此,本题正确答案是:![]() ;4Cu(OH)2 + N2H4 = 2Cu2O + N2↑ + 6H2O。
;4Cu(OH)2 + N2H4 = 2Cu2O + N2↑ + 6H2O。


科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是
A. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
B. 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O![]()
![]() +OH
+OH
C. 由Na和C1形成离子键的过程:![]()
D. 电解精炼铜的阴极反应:Cu2+ +2e![]() Cu
Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. AlCl3![]() Al(OH)3
Al(OH)3 ![]() [Al(OH)4 ]-
[Al(OH)4 ]-
B. Fe2O3(s) ![]() Fe(s)
Fe(s)![]() FeCl3(aq)
FeCl3(aq)
C. NaHCO3(s)![]() Na2CO3
Na2CO3![]() NaOH(aq)
NaOH(aq)
D. Al(s)![]() NaAlO2(aq)
NaAlO2(aq) ![]() Al(OH)3 (s)
Al(OH)3 (s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气在工业上有着重要的用途,某兴趣小组在实验室中模拟工业上用氯气制备无水氯化铝(无水AlCl3遇潮湿空气即产生大量白雾).可用下列装置制备.

(1)装置B中盛放__________溶液,其作用是___________.F中的是________溶液,其作用是_____________.用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为________.
(2)装置A实验开始时,先检查装置气密性,接下来的操作依次是_____________(填序号).
A.往烧瓶中加入MnO2粉末 B.加热 C.往烧瓶中加入浓盐酸
(3)制备反应会因盐酸浓度下降而停止.为测定反应残余液中盐酸的浓度,探究小组同学提出很多实验方案,其中方案之一为让残留的液体与足量Zn反应,测量生成的H2体积.装置如图所示(夹持器具已略去).反应完毕,每间隔1分钟读取气体体积、气体体积逐渐减小,直至不变.气体体积逐次减小的原因是____________________(排除仪器和实验操作的影响因素).

(4)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为﹣59℃,液体为红色;Cl2沸点为﹣34℃,液态为黄绿色.设计最简单的实验验证Cl2中含有ClO2___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(C1NO)是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用C12和NO制备C1NO并测定其纯度。请回答:
(I)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

(1)若制备C12发生装置选A,则反应的离子方程式为____________。若制备NO发生装置选B,锥形瓶中放的是Cu片,则分液漏斗中的试剂为________
(2)欲收集一瓶干燥纯净的氯气,选择装置,其连接顺序为:a→f→___→___→___→d→___→___→___(按气流方向,用小写字母表示),其中F装置的作用为____________。

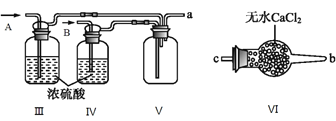
(II) 乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
(3)为了使气体充分反应,从A处进入的气体是____________(填Cl2或NO)。
(4)装置Ⅲ、Ⅳ除可干燥NO、Cl2外,另一个作用是________________________。
(5)装置Ⅷ的烧杯中盛放的试剂是_____________(填编号①水②热水③冰水)
(6)装置Ⅶ中吸收尾气时,NOCl发生反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是(______)(填序号)。
A.Cl2 B.淡水 C.烧碱 D.食盐
(2)下图是从海水中提取镁的简单流程。

①操作A是 _______________________。
②无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为_____。
③海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?____。
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:

①灼烧海带至灰烬时所用的主要仪器名称是(________)(填序号)。
a.坩埚 b.试管 c.蒸发皿 d.烧杯
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式________________。
③用CCl4提取碘时除了用CCl4还可以选用的试剂是(________)(填字母序号)。
a.苯 b.乙醇 c.乙酸
④为检验用CCl4提取碘后的水溶液中是否还含有碘单质。请写出该实验的实验步骤、现象及结论:_______。
(4)利用海底的“可燃冰”制作的燃料电池的总反应式为CH4+2O2+2KOH = K2CO3+3H2O,则该燃料电池的负极的电极反应为__________________。
(5)海底的煤经综合利用开发的副产物CO2能生产甲醇燃料,其反应的方程式为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。某科学实验将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标。
CH3OH(g)+H2O(g)。某科学实验将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标。

①a点正反应速率_________(填“大于、等于或小于”)a点逆反应速率。
②平衡时CO2的物质的量浓度是___________mol/L。
③能够说明该反应达到化学平衡状态的标志是_______(双选)。
A.单位时间内消耗1molCO2,同时生成3mol H2
B.混合气体的密度不随时间变化
C.CH3OH、H2的浓度不再随时间变化
D.CH3OH和H2O浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下的一密闭容器中事先放入1.56g过氧化钠,然后再通入乙烷与氧气的混合气体,用电火花引爆,直至反应完全为止,恢复到原温度,容器内压强近似为零。
(1)相同条件下,通入的气体氧气和乙烷的体积比是多少?_____
(2)通入氧气的质量最大应是多少?_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油墨、涂料、密封胶与胶粘剂等行业。在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。某校学生实验小组设计如图所示装置,制取该产品。D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。可选用的药品有:a.石灰石 b.饱和氯化钙溶液 c.6 mol/L盐酸 d.氯化铵 e.氢氧化钙。

(1)A中制备气体时,所需药品是(选填字母序号)_____________________。
(2)B中盛有饱和碳酸氢钠溶液,其作用是_____________________________。
(3)写出制取氨气的化学方程式:_____________________________________。
(4)在实验过程中,向C中通入气体有先后顺序,先通入气体的化学式是:__________。
(5)检验D出口处是否有氨气逸出的方法是______________________。
(6)写出制纳米级碳酸钙的化学方程式:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com