

������ | NiS | ZnS | CuS | CaF2 | MgF2 |
| �ܶȻ����� | 1.07��10-21 | 2.93��10-25 | 1.27��10-36 | 1.46��10-10 | 7.42��10-11 |
���� ������������ϡ����������ƣ��õ���Ni2+�Ľ���Һ������Ni��OH��2+2H+=Ni2++2H2O��3NiS+ClO3-+6H+=3Ni2++3S+Cl-+3H2O������1����S��[NaFe3��SO4��2��OH��6������Һ1�м���NiS������Һ��pH������2�к���CuS����Һ2�м���NaF���ɵõ�CaF2��MgF2�ȳ�������Һ3�к���Ni2+��Zn2+�������л���ȡ����ˮ���к���Ni2+����ˮ���м���̼���ƣ��ɵõ�NiCO3���Դ˽����⣮
��� �⣺������������ϡ����������ƣ��õ���Ni2+�Ľ���Һ������Ni��OH��2+2H+=Ni2++2H2O��3NiS+ClO3-+6H+=3Ni2++3S+Cl-+3H2O������1����S��[NaFe3��SO4��2��OH��6������Һ1�м���NiS������Һ��pH������2�к���CuS����Һ2�м���NaF���ɵõ�CaF2��MgF2�ȳ�������Һ3�к���Ni2+��Zn2+�������л���ȡ����ˮ���к���Ni2+����ˮ���м���̼���ƣ��ɵõ�NiCO3��
��1����ȡ�����У�Ϊ��߽���Ч�ʿɲ��õĴ�ʩ�У��ɽ���ʯ�������߽�ȡʱ���¶ȣ����ʵ��������Ũ�ȵȣ��ʴ�Ϊ������ʯ���飨����߽�ȡʱ���¶ȣ����ʵ��������Ũ�ȵȺ����𰸾��ɣ���
��2����ȡ��Ni2+ʱ��Ӧ�����ӷ���ʽ�Т�Ni��OH��2+2H+=Ni2++2H2O��3NiS+ClO3-+6H+=3Ni2++3S+Cl-+3H2O���˷�Ӧ�л�ԭ����ΪCl-����������ΪS�����ߵ����ʵ�����Ϊ1��3��
�ʴ�Ϊ��Ni��OH��2+2H+=Ni2++2H2O��1��3��
��3�����������ӷ�Ӧ����ʽΪ3Fe3++3CO32-+Na++2SO42-+3H2O=NaFe3��SO4��2��OH��6+3CO2����
�ʴ�Ϊ��3Fe3++3CO32-+Na++2SO42-+3H2O=NaFe3��SO4��2��OH��6+3CO2����
��4������NiS�������dz�ȥ��Һ�е�Cu2+����Ӧ�����ӷ���ʽΪCu2++NiS=Ni2++CuS����Һ��c��Ni2+��=0.107 mol•L-1ʱ��c��S2-��=$\frac{1.07��1{0}^{-21}}{0.107}$mol/L=1��10-20mol/L����Һ�в���c��Cu2+��=$\frac{1.27��1{0}^{-36}}{1��1{0}^{-20}}$mol/L=1.27��10-16mol/L��
�ʴ�Ϊ��Cu2++NiS=Ni2++CuS��1.27��10-16mol/L��
��5������NaF��������CaF2���������ڳ�ȥCa2+���л���ȡ�����ڳ�ȥ��Һ�е�Zn2+���ʴ�Ϊ����ȥCa2+����ȥZn2+��
���� ���⿼�����ʷ�����ᴿ��ʵ��װ���ۺϵ�֪ʶ�㣬Ϊ��Ƶ���㣬��ȷ���ʵ����ʼ�ʵ�鲽���ǽⱾ��ؼ���֪������ͼ�з����ķ�Ӧ������������������Ŀ�Ѷ��еȣ�


 ����������ϵ�д�
����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ӧ�����Һ�����Ҵ�����Һû�з����仯 | |
| B�� | �����ܽ����������ɫ���������[Cu��NH3��4]2+ | |
| C�� | ��[Cu��NH3��4]2+�����У�Cu2+�����¶Ե��ӣ�NH3�ṩ�չ�� | |
| D�� | ��Ӧ����Һ�в������κγ��������Է�Ӧǰ��Cu2+��Ũ�Ȳ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
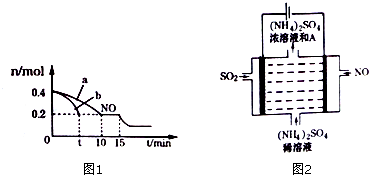
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʹʪ�����ɫʯ����ֽ���������ǰ��� | |
| B�� | ������������Na2CO3��ʯӢ��Na2SiO3�ķ�Ӧ���� | |
| C�� | ��Na2CO3��Һ��������ϴ�;��ϵ����� | |
| D�� | ij��Һ�м���BaCl2��Һ������������ϡ����ij���������Һһ������SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 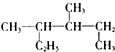 ��ϵͳ������3��4-�������� ��ϵͳ������3��4-�������� | |
| B�� | ӣ���к���һ���ǻ��ᣨ��ͼ��ʾ��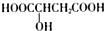 �����ǻ�����Է���ȡ�������������۵ȷ�Ӧ �����ǻ�����Է���ȡ�������������۵ȷ�Ӧ | |
| C�� | ���е��ǡ���֬�������ʶ���ˮ�⣬��ˮ����ﲻͬ | |
| D�� | �������ļ�ȩ��������ȼ�պ�������ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | B3N3H6���Ӹ�ԭ�Ӿ���ͬһƽ���� | |
| B�� | B3N3H6���ɼ��Լ���ɵľ��ȶ��ԳƵķǼ��Է��� | |
| C�� | B3N3H6�ܷ����ӳɷ�Ӧ��ȡ����Ӧ | |
| D�� | B3N3H6�Ķ���ȡ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | H2��g�� | CO2��g�� | CH2=CH2 | H2O��g�� |
| ������KJ/mol | 0 | -394 | 52 | -242 |

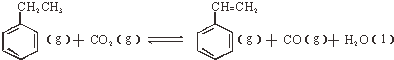 ����H��0
����H��0�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
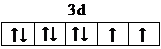 ���ܶ�����л�����E���¿���H2�����ӳɷ�Ӧ�����CH2=CH2����HC��CH����
���ܶ�����л�����E���¿���H2�����ӳɷ�Ӧ�����CH2=CH2����HC��CH����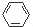 ����HCHO������̼ԭ�Ӳ�ȡsp2�ӻ��ķ����Т٢ۢܣ���������ţ���HCHO���ӵ�����ṹΪƽ�������Σ����ӳɲ�����ۡ��е��CH4���ۡ��е�ߣ�����Ҫԭ���ǣ���ָ���ӳɲ����Ǻ����ʣ��ӳɲ���CH3OH����֮�����γ������
����HCHO������̼ԭ�Ӳ�ȡsp2�ӻ��ķ����Т٢ۢܣ���������ţ���HCHO���ӵ�����ṹΪƽ�������Σ����ӳɲ�����ۡ��е��CH4���ۡ��е�ߣ�����Ҫԭ���ǣ���ָ���ӳɲ����Ǻ����ʣ��ӳɲ���CH3OH����֮�����γ������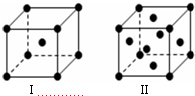
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com