
| A. | 1、2 | B. | 3、4 | C. | 1、1 | D. | 3、2 |
分析 混合物在密闭容器中加热到300℃时,可能发生如下反应:①2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O↑
②2Na2O2+2CO2=2Na2CO3+O2③2Na2O2+2H2O=4NaOH+O2碳酸氢钠分解产生的气体其中二氧化碳先和过氧化钠反应,然后是水和过氧化钠反应,根据反应物、生成物进行讨论分析.
解答 解:混合物在密闭容器中加热到300℃时,可能发生如下反应:
①2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O↑
2 1 1
bmol 0.5bmol0.5bmol
②2Na2O2+2CO2=2Na2CO3+O2
2 2
0.5bmol 0.5bmol
③2Na2O2+2H2O=4NaOH+O2
2 2
0.5bmol 0.5bmol
已知,生成的产物固体有NaOH、Na2CO3.则反应②进行完全了反应③已经发生了,且反应③中Na2O2不足量,
所以:a>0.5b、a<b整理得:1>$\frac{a}{b}$>$\frac{1}{2}$,B符合,故选B.
点评 本题考查混合物反应的计算,题目难度中等,明确发生反应原理为解答关键,注意掌握常见反应方程式,试题培养了学生的分析、理解能力及化学计算能力.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:选择题
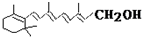 ,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来,关于它的叙述正确的是( )
,式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C、H原子未标记出来,关于它的叙述正确的是( )| A. | 维生素A的分子式为C20H32O | |
| B. | 维生素A不能使溴的四氯化碳溶液褪色 | |
| C. | 该有机物能发生取代反应 | |
| D. | 1mol维生素A 在催化剂作用下最多可与7molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯可用作水果的催熟剂 | |
| B. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 | |
| C. | 二氧化硫可用作食品的漂白剂 | |
| D. | 交警可用酸性重铬酸钾来检测司机是否酒驾 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有少量碳酸氢钙和氯化钙的水是永久硬水 | |
| B. | 明矾有净水作用,所以用明矾处理硬水,可以使硬水软化 | |
| C. | 用离子交换剂处理硬水,可使硬水软化 | |
| D. | 只具有永久硬度的水经加热煮沸后,可变成软水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
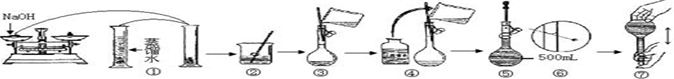
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com