
| A. | 将 SO2 通入水中 | B. | 将 HCl 通入水中 | C. | 烧碱溶于水 | D. | 硫酸氢钾溶于水 |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,电解质溶于水电离时破坏化学键,据此分析解答.
解答 解:A.二氧化硫和水反应生成亚硫酸,亚硫酸电离生成氢离子和亚硫酸氢根离子,二氧化硫、亚硫酸中都只含共价键,二氧化硫和水反应生成亚硫酸有共价键的破坏和形成,亚硫酸电离有共价键的破坏,故A不选;
B.HCl在水分子的作用下电离出阴阳离子,HCl中只含共价键,所以只有共价键的破坏,故B不选;
C.NaOH溶于水电离生成钠离子和氢氧根离子,所以只破坏离子键,故C不选;
D.硫酸氢钾溶于水电离生成钾离子、氢离子和硫酸根离子,有离子键和共价键的破坏,故D选;
故选D.
点评 本题考查化学键,为高频考点,明确物质构成微粒及微粒之间作用力是解本题关键,注意:硫酸氢钾在水溶液中电离生成氢离子、钾离子和硫酸根离子,而熔融状态下电离生成钾离子和硫酸氢根离子,题目难度不大.


科目:高中化学 来源: 题型:推断题
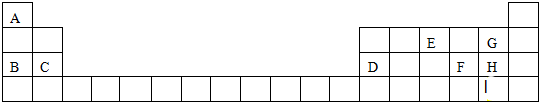
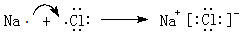 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 列 周期 | 1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠投入水中,浮在水面熔成小球,并在水面快速移动,得到的溶液显碱性;Na+H2O═Na++OH-+H2↑ | |
| B. | 氢气在氯气中安静的燃烧,发出淡蓝色火焰,瓶口出现白雾;H2+Cl2═2HCl | |
| C. | 铜与稀硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol H2的质量只有在标准状况下才约为2g | |
| B. | 标准状况下,22.4L氖气含有的原子数为2NA | |
| C. | 标准状况下,18g水的体积约为22.4L | |
| D. | 同温同压下,相同体积的气体单质含有的原子数目不一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D 是原子序数依次增大的短周期主族元素,A 的基态原子中电 子占据三个能级,且各个能级的电子数相等;B 的一种氧化物为红棕色气体;C 的原子半径 是短周期中最大的.D 的电负性是同周期中最大的;E 是第四周期第VIII族三种元素中原子序数 最小的元素.用元素符号回答下列问题:
A、B、C、D 是原子序数依次增大的短周期主族元素,A 的基态原子中电 子占据三个能级,且各个能级的电子数相等;B 的一种氧化物为红棕色气体;C 的原子半径 是短周期中最大的.D 的电负性是同周期中最大的;E 是第四周期第VIII族三种元素中原子序数 最小的元素.用元素符号回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com