
| A、铁粉加入到FeCl3溶液中:Fe+Fe3+=2Fe2+ |
| B、过量的氨水滴加到氯化铝溶液:Al3++4OH-═AlO2-+2H2O |
| C、氯气与水反应:Cl2+H2O═Cl-+2H++ClO- |
| D、硅酸钠溶液中通入过量CO2:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- |


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、a是阴极 |
| B、电解过程中溶液的浓度不变 |
| C、电解过程中b极质量减少 |
| D、阳极与阴极上的产物的物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 化学反应 | 离子方程式 | 评价 |
| A | 把MgSO4溶液滴入Ba(OH)2溶液 | Mg2++2OH-═Mg(OH)2↓ | 正确 |
| B | 向小苏打溶液中加足量氢氧化钠溶液 | HCO3-+OH-═CO2↑+H2O | 正确 |
| C | 向FeCl2溶液中通入氯气 | 2Fe2++Cl2═2Fe3++2Cl- | 不正确 |
| D | 氧化钙与稀盐酸反应 | CaO+2H+═Ca2++H2O | 正确 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
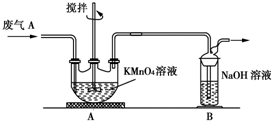 硫酸工业产生的废气A(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境.某化学兴趣小组对废气A的组成进行探究,请回答下列问题.
硫酸工业产生的废气A(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境.某化学兴趣小组对废气A的组成进行探究,请回答下列问题.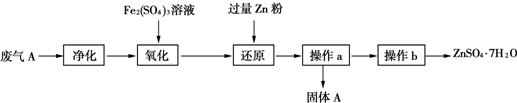
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸稀释后马上转移至容量瓶 |
| B、溶解搅拌时有液体飞溅 |
| C、容量瓶洗净后没有干燥 |
| D、定容时仰视容量瓶瓶颈刻度线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com