

分析 依据流程分析,铝土矿加入盐酸溶解过滤得到二氧化硅固体和滤液A,滤液A中含有氯化铁、氯化亚铁、氯化铝,在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性,次氯酸根离子具有氧化性氧化亚铁离子为铁离子在溶液中形成氢氧化铁沉淀除去,反应的化学方程式为:2Fe2++ClO-+5H2O=2Fe(OH)3↓+C1-+4H+;
二氧化硅加入氢氧化钠固体焙烧得到硅酸钠,
(1)①Al2O3与氢氧化钠溶液反应生成偏铝酸钠和水,据此书写离子方程式;
②滤液B中铝元素为氯化铝,依据氢氧化铝溶液强酸强碱,不溶于弱酸弱碱选择;
③加入浓盐酸抑制氯化铝的水解,蒸发浓缩冷却结晶,过滤洗涤;
(2)a、蒸发皿中含有二氧化硅和氢氧化钠反应;
b、铁坩埚可以熔融二氧化硅和氢氧化钠;
c、玻璃中含二氧化硅和氢氧化钠反应;
d、瓷坩埚含有二氧化硅和氢氧化钠反应;
解答 解:(1)①Al2O3与氢氧化钠溶液反应生成偏铝酸钠和水,据此书写离子方程式为:Al2O3+2OH-+3H2O=2[Al(OH)4]-,
故答案为:Al2O3+2OH-+3H2O=2[Al(OH)4]-;
②滤液中含有的是氯化铝溶液,将滤液B中的铝元素以沉淀形式析出;
a、氢氧化钠溶液可以沉淀铝离子但过了会溶解氢氧化铝,故a不是最好;
b.硫酸溶液不能沉淀铝离子,故b不符合;
c.氨水是弱碱不能溶解氢氧化铝,过量的氨水和铝离子形成氢氧化铝沉淀过滤得到氢氧化铝固体,故c符合;
d.二氧化碳和氯化铝不反应不能生成氢氧化铝沉淀,故d不符合;
故答案为:c;
③加入浓盐酸抑制氯化铝的水解,蒸发浓缩冷却结晶,过滤,洗涤;
故答案为:过滤;
(2)A、蒸发皿中含有二氧化硅和氢氧化钠反应,故A不符合;
B、铁坩埚可以熔融二氧化硅和氢氧化钠,故B符合;
C、玻璃中含二氧化硅和氢氧化钠反应,故C不符合;
D、瓷坩埚含有二氧化硅和氢氧化钠反应,故D不符合;
故答案为:B.
点评 本题考查了铁、铝性质的综合应用和氧化铝提纯制备流程分析应用,注意蒸干灼烧熔融氢氧化钠的仪器选择,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2017届广西桂林十八中高三上10月月考化学试卷(解析版) 题型:选择题
金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是( )
A.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于 氧气扩散至电极表面
氧气扩散至电极表面
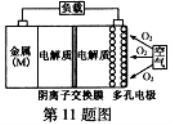 B.比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
B.比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
C.M–空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
D.在M–空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量二氧化锰与浓盐酸共热反应 | |
| B. | 过量的氢气与少量氮气在一定条件下充分反应 | |
| C. | 过量铜与浓硫酸共热反应 | |
| D. | 过量氨水与硝酸银溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com