
【题目】完全沉淀相同体积的NaCl、MgCl2、AlCl3溶液中的Cl-,消耗相同浓度的AgNO3溶液的体积之比为3:2:1,则NaCl、MgCl2、AlCl3溶液的物质的量浓度之比为( )
A. 1:2:3 B. 3:2:1 C. 6:3:2 D. 9:3:1
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案科目:高中化学 来源: 题型:
【题目】下列各项中括号里的物质是除去杂质所用的药品,其中错误的是( )
A. SO2中混有HCl气体(氢氧化钠溶液) B. CO中混有CO2(石灰水、浓H2SO4)
C. CO2中有少量CO(灼热的氧化铜) D. Cl2中混有HCl(饱和食盐水、浓H2SO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料和燃料。将CO2与含少量CO的H2混合,在恒容密闭容器中发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+ H2O(g),图1是在两种投料比[c(CO2)/c(H2+ CO)]分别为1:4和1:6时,CO2平衡转化率随温度变化的曲线, 图2是生成的甲醇/过氧化氢燃料电池的工作原理示意图
CH3OH(g)+ H2O(g),图1是在两种投料比[c(CO2)/c(H2+ CO)]分别为1:4和1:6时,CO2平衡转化率随温度变化的曲线, 图2是生成的甲醇/过氧化氢燃料电池的工作原理示意图

下列有关说法正确的是
A. 图1中b点对应的平衡常数K值大于c点
B. 图1中a点对应的H2的转化率等于30%
C. 图2中电极M上发生还原反应
D. 图2中电极N的反应式: H2O2 +2e- + 2H+= 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石墨为电极,电解KI溶液(其中含有少量酚酞)。下列说法正确的是( )
A. 阴极逸出气体 B. 阳极附近溶液呈红色
C. K+向阳极迁移 D. 溶液的pH逐渐变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医疗上常用硫酸钡作X射线透视肠胃的内服药剂,俗称“钡餐”,碳酸钡却不能作“钡餐”,这是因为
A. 硫酸钡不溶于水,碳酸钡溶于水
B. 硫酸钡是强酸盐,碳酸钡是弱酸盐
C. 硫酸钡不溶于水但溶于酸,碳酸钡不溶于水也不溶于酸
D. 硫酸钡不溶于水也不溶于酸,碳酸钡不溶于水但能溶于酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出[Ag(NH3)2]OH的中心离子的核外电子排布式________、配位体的电子式________、配位体的杂化方式是________写出[Ag(NH3)2]OH电离的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【成都市2017届第二次模拟考试】前四周期元素A、B、C、D、E的原子序数依次增大,A的质子数等于周期数,B与C的 P轨道均有三个成单电子,D的最高正价与最低负价代数和为4,E的最外层只有一个电子, 内层轨道处于全充满状态。试回答下列问题。
(1)基态E原子的电子排布式为_________;C和D的第一电离能较大的________(填元素符号)。
(2)DO32-中D原子的杂化类型为_________;A、D和氧元素组成的液态化合物A2DO4中存在的作用力有_____________。
(3)结构式为A—B=B—A的分子中σ键和π键的数目比为________;B2分子和NO+离子互为等离子体,则NO+的电子式为___________。
(4)向EDO4溶液中加入过量稀氨水,其化学方程式为______;产物中阳离子的配体是______(填化学式)。
(5)D(黑球)和E(白球)形成某种晶体的晶胞如图所示。已知该晶体的晶胞边长为516Pm,则黑球和白球之间最近距离为________pm(精确到0.1,已知![]() =1.732)若ED中D2-被O2-代替,形成的晶体只能采取NaCl型堆积,试从晶体结构分析其不同及原因__________。
=1.732)若ED中D2-被O2-代替,形成的晶体只能采取NaCl型堆积,试从晶体结构分析其不同及原因__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【江西省师范大学附属中学2017届第三次模拟】三盐(3PbO·PbSO4·H2O,相对分子质量为990)可用作聚氯乙烯的热稳定剂, 不溶于水。以200.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。
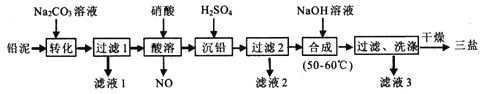
已知:Ksp(PbSO4)=1.82×l0-8;Ksp(PbCO3)=l.46×l0-13。
回答下列问题:
(1)加Na2CO3溶液转化的目的是_________.
(2)酸溶时,不直接使用H2SO4溶液的原因可能是________;铅与硝酸在酸溶过程中发生反应的离子方程式为__________.
(3)流程中可循环利用的物质是_________;洗涤操作时,检验沉淀是否洗涤干净的方法是________。
(4)当沉淀转化达平衡时,滤液l中c(SO42-)与c(CO32-)的比值为_____________。
(5) 50-60℃时合成三盐的化学方程式为______;若得到纯净干燥的三盐99.0t,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com