
分析 根据AlCl3的物质的量和Al(OH)3沉淀的质量判断出AlCl3没有完全生成Al(OH)3沉淀,存在两种情况:NaOH不足;NaOH过量,部分生成NaAlO2,根据反应的化学方程式讨论计算.
解答 解:n(AlCl3)=cV=100×10-3L×0.5mol•L-1=0.05mol,
沉淀的物质的量n=$\frac{m}{M}$=$\frac{2.34g}{78g/mol}$=0.03mol,
则AlCl3没有完全生成Al(OH)3沉淀,存在两种情况:
(1)NaOH不足,
AlCl3+3NaOH=Al(OH)3↓+3NaCl
3 1
n 0.03mol
n=0.09mol,
V(NaOH)=$\frac{0.09mol}{0.1mol/L}$=0.9L,
(2)NaOH过量,部分生成NaAlO2,
AlCl3+3NaOH=Al(OH)3↓+3NaCl
1 3 1
0.05mol 0.15mol 0.05mol
Al(OH)3+NaOH=NaAlO2+2H20
1 1
0.02mol 0.02mol
共需n(NaOH)=0.15mol+0.02mol=0.17mol,
V(NaOH)=$\frac{0.17mol}{0.1mol/L}$=1.7L,
答:用去的NaOH溶液的体积为0.9L或1.7L.
点评 本题考查化学方程式的计算,题目难度中等,注意根据反应物的物质的量和沉淀的质量判断反应的程度,用讨论的方法计算.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.0mol的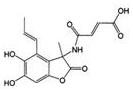 与NaOH溶液和H 2反应时,分别需要消耗NaOH 6.0mol和H 25.0mol 与NaOH溶液和H 2反应时,分别需要消耗NaOH 6.0mol和H 25.0mol | |
| B. | 乙醇、乙酸和乙酸乙酯不能用饱和Na 2CO 3溶液鉴别 | |
| C. | 桶烯(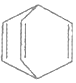 )与苯乙烯 )与苯乙烯 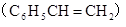 互为同分异构体,均属于芳香烃 互为同分异构体,均属于芳香烃 | |
| D. | 按系统命名法,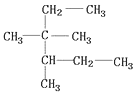 的名称为3,3二甲基2乙基戊烷 的名称为3,3二甲基2乙基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
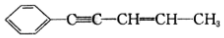 ,有关其结构说法正确的是( )
,有关其结构说法正确的是( )| A. | 同一平面上的碳原子至少有9个 | B. | 所有碳原子可能在同一条直线上 | ||
| C. | 所有碳原子不可能在同一平面上 | D. | 所有碳原子可能在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不变 | B. | 增大 | C. | 减小 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入NH4HS固体 | B. | 压强、温度不变,充入少量氩气 | ||
| C. | 容积、温度一定,充入氦气 | D. | 温度、容积一定,充入H2S气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com