
下列叙述正确的是
A.乙烯和苯都能使溴水褪色,褪色的原理相同
B.乙醇、乙酸、乙酸乙酯都能发生取代反应
C.淀粉、油脂、蛋白质的水解产物互为同分异构体
D.纤维素、聚乙烯、光导纤维都属于高分子化合物
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源:2015届天津市五区县高二上学期期末考试化学试卷(解析版) 题型:填空题
导致空气污染的主要原因来自于化石燃料燃烧、硫酸工业和汽车尾气的排放;致使大量二氧化硫和氮氧化物排入大气中。利用化学反应原理研究治理环境污染的方法是当前环保工作的重要研究内容之一。
(1)反应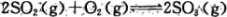 是硫酸工业中的重要反应;提高SO2的平衡转化率有利于减少尾气排放:已知该反应是放热反应;当该反应处于平衡状态时,为了提高SO2的转化率:下列可采用的措施是
是硫酸工业中的重要反应;提高SO2的平衡转化率有利于减少尾气排放:已知该反应是放热反应;当该反应处于平衡状态时,为了提高SO2的转化率:下列可采用的措施是
A.加入V2O5作催化剂 B.通入过量空气 C.高温 D.增大压强
(2)一定条件下,向2L密闭容器中通入2molSO2(g)、1molO2(g)和0.2SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K=_________;用O2的浓度变化表示从O-2min内该反应的平均速率v=_________;恒温下,若向容器中再加入2molSO2(g),则重新达到平衡时SO2的总转化率____________50%(填“>”、“<”、“=”)
(3)能说明该反应已经达到平衡状态的是
A. B.容器内压强保持不变.
B.容器内压强保持不变.
C.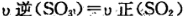 D.容器内物质的密度保持不变.
D.容器内物质的密度保持不变.
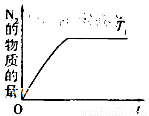
(4)在催化剂作用下用CH4将氮氧化物还原为N2可以消除氮氧化物带来的污染, 请写出CH4与NO反应的化学方程式:_________;温度为T1时在密闭容器中研究CH4催化还原氮氧化物的反应,反应过程中产物N2的物质的量随时间的变化曲线如图所示,请在图中补画出温度为T2(T2>T1)时,n(N2)的变化曲线(已知该反应是放热反应)。
查看答案和解析>>
科目:高中化学 来源:2015届吉林省高二教学评估(一)化学试卷(解析版) 题型:选择题
现有溴苯、乙醇、甲苯、己烯四种液体,只用一种试剂就可以将它们区别开,这种试剂是( )
A.溴水 B.食盐水 C.NaOH溶液 D.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源:2015届吉林省高二3月月考化学试卷(解析版) 题型:选择题
下列化合物①NaHCO3,②Al(OH)3,③AlCI3,④H2N﹣CH2﹣COOH,⑤Na2CO3跟盐酸和氢氧化钠溶液都能反应的是
A.②③④ B.①②④ C.Z①②③ D.②④⑤
查看答案和解析>>
科目:高中化学 来源:2015届吉林省高二3月月考化学试卷(解析版) 题型:选择题
在实验室中进行下列实验,括号内的实验用品都能用到的是
A.硫酸铜晶体里结晶水含量的测定(坩埚、温度计、硫酸铜晶体)
B.蛋白质的盐析(试管、醋酸铅溶液、鸡蛋白溶液)
C.钠的焰色反应(铂丝、氯化钠溶液、稀盐酸)
D.肥皂的制取(蒸发皿、玻璃棒、甘油)
查看答案和解析>>
科目:高中化学 来源:2015届北京市怀柔区高二上学期期末质量检测化学试卷(解析版) 题型:填空题
从某些植物树叶提取的挥发油中含有下列主要成分:
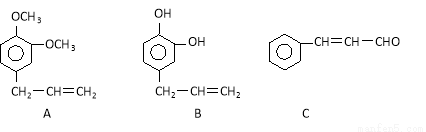
(1)写出A的分子式
(2)1molB与溴水充分反应,需消耗 mol单质溴。
(3)C与氢气完全加成后的产物的结构简式 。
(4)已知:RCH=CHR,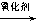 RCOOH+R,COOH。写出C在强氧化剂条件下生成的有机化合物的结构简式 。
RCOOH+R,COOH。写出C在强氧化剂条件下生成的有机化合物的结构简式 。
查看答案和解析>>
科目:高中化学 来源:2015届北京市怀柔区高二上学期期末质量检测化学试卷(解析版) 题型:选择题
我校即将进行寒假实践活动,某同学用化学知识解决生活中的问题不合理的是
A.用食醋除去暖水瓶中的水垢
B.用米汤检验食盐中是否含碘酸钾
C.用热的纯碱溶液洗涤餐具上的油
D.用灼烧并闻气味的方法区别纯棉和纯羊毛织物
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题9有机化合物的获取与应用练习卷(解析版) 题型:填空题
下图中A、B、C、D、E、F、G均为有机化合物。
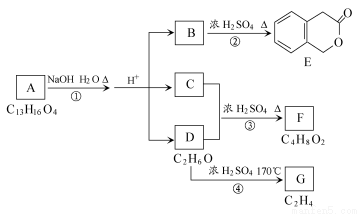
根据上图回答问题:
(1)D的化学名称是________________________。
(2)反应③的化学方程式是________________________________。(有机物须用结构简式表示)
(3)B的分子式是__________________________。
(4)反应①的反应类型是__________________。A的结构简式是_______。
(5)符合下列3个条件的B的同分异构体的数目有____________个。
①含有邻二取代苯环结构;②与B有相同的官能团;③不与FeCl3溶液发生显色反应。写出其中任意一个同分异构体的结构简式________________。
(6)G的重要的工业原料,用化学方程式表示G的一种重要的工业用途________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题7化学反应速率与化学平衡练习卷(解析版) 题型:填空题
用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g)+2N2(g)+6H2(g) 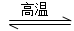 Si3N4(s)+12HCl(g) ΔH<0
Si3N4(s)+12HCl(g) ΔH<0
完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为2 L,3 min后达到平衡,测得固体的质量增加了2.80 g,则H2的平均反应速率为________mol/(L·min);该反应的平衡常数表达式K=________。
(2)上述反应达到平衡后,下列说法正确的是________。
a.其他条件不变,压强增大,平衡常数K减小
b.其他条件不变,温度升高,平衡常数K减小
c.其他条件不变,增大Si3N4物质的量平衡向左移动
d.其他条件不变,增大HCl物质的量平衡向左移动
(3)一定条件下,在密闭恒容的容器中, 能表示上述反应达到化学平衡状态的是________。
a.3v逆(N2)=v正(H2)
b.v正(HCl)=4v正(SiCl4)
c.混合气体密度保持不变
d.c(N2):c(H2):c(HCl)=1:3:6
(4)若平衡时H2和HCl的物质的量之比为m/n,保持其他条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比________m/n(填“>”、“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com