
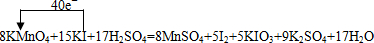
分析 反应KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O中,Mn元素化合价降低,由+7价降低到+2价,被还原,KMnO4为氧化剂,I元素化合价升高,由-1价升高到0价和+5价,KI为还原剂,则氧化产物为I2和KIO3,结合氧化还原反应中氧化剂和还原剂之间得失电子数目相等配平方程式并标出电子转移的方向和数目,以此解答.
解答 解:(1)KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O反应中,锰元素化合价由+7价降低为+2价,锰元素被还原,还原产物是MnSO4,KMnO4是氧化剂,
故答案为:KMnO4;
(2)如果该反应方程式中I2和KIO3的化学计量数都是5,则I元素失去电子的数目为2×5(1-0)+5×[5-(-1)]=40,则KMnO4的化学计量数应为$\frac{40}{7-2}$=8,结合质量守恒可知该反应化学方程式为8KMnO4+15KI+17H2SO4═8MnSO4+5I2+5KIO3+9K2SO4+17H2O,电子转移方向和数目可表示为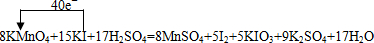 ,
,
故答案为:8;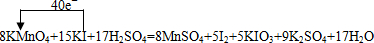 ;
;
(3)ABC均具有还原性,均能被高锰酸钾氧化,故答案为:ABC.
点评 本题考查氧化还原反应,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意从元素化合价的角度认识相关概念并把握物质的性质,题目难度不大.


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 0.89 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +2 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
 ,属离子化合物(填“离子”或“共价”).
,属离子化合物(填“离子”或“共价”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然橡胶的主要成分是异戊二烯 | |
| B. | 通过物理变化将煤气化和液化,能高效清洁地用煤 | |
| C. | 苯酚能用于环境消毒 | |
| D. | 乙醇是不可再生的能源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com