
【题目】下列化学方程式或离子方程式不正确的是( )
A. 溴乙烷在氢氧化钠水溶液中的反应:CH3CH2Br + OH-![]() CH3CH2OH +Br-
CH3CH2OH +Br-
B. 制备酚醛树脂的化学方程式:
C. 苯酚钠溶液中通入少量二氧化碳:C6H5O-+ CO2 + H2O→C6H5OH + CO32-
D. 甲醛溶液与足量的银氨溶液共热HCHO+4[Ag(NH3)2]++4OH-![]() CO32-+2NH4+ +4Ag↓+6NH3+2H2O
CO32-+2NH4+ +4Ag↓+6NH3+2H2O
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.常温常压下,80g Br2含有的原子数为NA
B.标准状况下,22.4L CCl4含有的分子数为NA
C.1mol·L-1Fe2(SO4)3溶液中含SO42-的数目为3NA
D.4.6g Na露置在空气中充分反应,转移的电子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列说法正确的是

A. a为直流电源的负极
B. 阴极的电极反应式为2HSO3-+2H++e-=S2O42-+2H2O
C. 阳极的电极反应式为SO2+2H2O-2e-=SO42-+4H+
D. 电解时,H+由阴极室通过阳离子交换膜到阳极室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究硫酸亚铁的分解产物,进行了如下图装置所示的实验,打开K1和K2,缓缓通入N2,一段时间后加热,实验后反应管中残留固体为红色粉末,BaCl2溶液中有白色沉淀产生,品红溶液中红色褪去,检查氢氧化钠溶液出口处无氧气产生。下列说法错误的是

A. 氢氧化钠溶液的作用是吸收多余的SO2气体
B. 反应管内产生的红色粉末可能是Fe2O3
C. BaCl2溶液的目的是检验SO3的存在,此处用Ba(NO3)2溶液也可以检验SO3
D. 反应管内得到的氧化产物和还原产物物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(22Ti)由于其特殊的性能被誉为“未来世纪的金属”。钛铁矿主要成分为FeTiO3(含有少量MgO、SiO2等杂质),Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿来制备,工艺流程如下:

(1)Ti位于元素周期表中的位置为________。钛铁矿在预处理时需要进行粉碎,其原因是_______。
(2)过程①中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为80%时,所采用的实验条件是_________。

(3)过程②中固体TiO2与双氧水、氨水反应转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图所示,反应温度过高时,Ti元素浸出率下降的原因是___________。
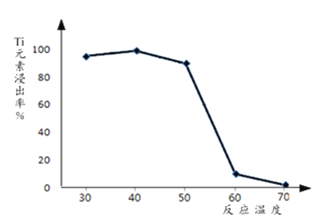
(4)写出由滤液D生成FePO4的离子方程式____________________________________。
(5)由流程图可知FePO4制备LiFePO4的化学方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法正确的是
A. 18.0 g淀粉[(C6H10O5)n]和葡萄糖混合物中共含碳原子数为0.6 NA
B. 标准状况下,22.4 L己烷含有的分子数为NA
C. 14g聚乙烯含有的碳原子数目为NA
D. 1 mol 羟基中含有的电子数10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用下图所示的装置制备干燥、纯净的氯气。下列有关叙述不正确的是( )
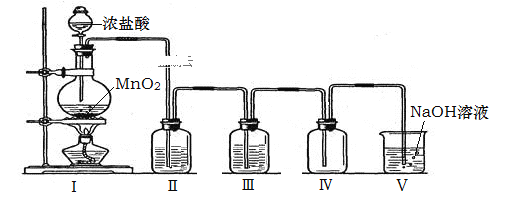
A.本实验操作顺序为:检验装置气密性→添加固体药品→添加液体药品→加热
B.装置Ⅱ、Ⅲ中的试剂依次为浓硫酸、饱和NaCl溶液
C.氯气密度比空气大,故装置Ⅳ中长导管进气,短导管出气
D.装置Ⅴ中反应的离子方程式为:Cl2+2OH﹣=Cl﹣+ClO﹣+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物有不同的分类方法,下列说法正确的是( )
①从组成元素分:烃、烃的衍生物
②从分子中碳骨架形状分:链状有机化合物、环状有机化合物
③从官能团分:烯烃、炔烃、卤代烃、醇、酚、醛、酮、羧酸、酯等
④![]() 可划分为烃、链状有机化合物、羧酸
可划分为烃、链状有机化合物、羧酸
A. ①③④B. ①②③C. ①②④D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上综合利用铝土矿的部分工艺流程如下。
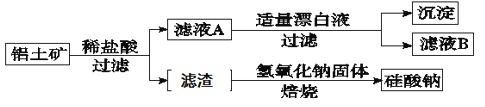
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。 该过程中涉及某氧化还原反应如下,请完成:□Fe2++□ClO-+ = □Fe(OH)3↓+□Cl-+ 。_________
(2)检验滤液B中是否还含有Fe2+的方法为:__________。
(3)将滤液B中的铝元素以沉淀形式析出,选用的最好试剂为______(填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
(4)由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、_________(填操作名称)、过滤、洗涤。
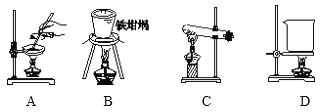
(5)滤渣的主要成分是____________(填化学式),其与NaOH固体焙烧制备硅酸钠,可采用的装置为____(填代号),该反应的化学方程式是 ________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com