
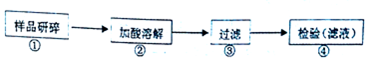
分析 Ⅰ.(1)依据过滤装置和操作选择需要的玻璃仪器;
(2)①检验Fe3+的试剂是硫氰酸钾溶液,遇到铁离子变化为血红色;
②证明该滤液中既有Fe2+又有Fe3+,亚铁离子检验需要利用其还原性,选择高锰酸钾溶液,铁离子检验选择KSCN溶液检验;
Ⅱ.(3)2FeCl3+SnCl2=2FeCl2+SnCl4;6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,得到6FeCl3~6FeCl2~6Fe2+~Cr2O72-,据此计算;
解答 解:I.(1)过滤操作中用到的玻璃仪器有玻璃棒、普通漏斗、烧杯,
故答案为:玻璃棒、普通漏斗、烧杯;
(2)①检验Fe3+选KSCN溶液,铁离子遇到KSCN溶液变血红色,
故答案为:KSCN溶液;
②证明该滤液中既有Fe2+又有Fe3+,亚铁离子检验需要利用其还原性,选择高锰酸钾溶液,铁离子检验选择KSCN溶液检验,步骤和现象为:取适量滤液分别加入两支试管中,在一支试管中滴入酸性KMnO4溶液,振荡后KMnO4溶液褪色,说明有Fe3+;再在另一支试管中滴入KSCN溶液,溶液变红,说明有Fe3+,
故答案为:取适量滤液分别加入两支试管中,在一支试管中滴入酸性KMnO4溶液,振荡后KMnO4溶液褪色,说明有Fe3+;再在另一支试管中滴入KSCN溶液,溶液变红,说明有Fe3+;
II.(3)2FeCl3+SnCl2=2FeCl2+SnCl4;6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,
得到6FeCl3~6FeCl2~6Fe2+~Cr2O72-,
6 1
n 0.0 20L×0.25mol/L
n=0.0 20L×0.25mol/L×6=0.03mol
200ml滤液中铁元素物质的量=0.03mol×$\frac{200ml}{20ml}$=0.3mol,
矿石样品中铁元素的质量分数=$\frac{0.3mol×56g/mol}{28g}$×100%=60%,
故答案为:60%;
点评 本题考查了物质提取、物质分离和物质检验方法等知识点,掌握基础是解题关键,题目难度中等.


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 阳极 | 石墨棒 | Cu | Cu | Cu |
| 阴极 | 石墨棒 | 石墨棒 | Fe | Pt |
| 电解质 溶液 | CuSO4 溶液 | Na2SO4 溶液 | H2SO4 溶液 | CuSO4 溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
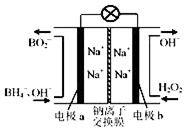 以硼氢化合物NaBH4(强电解质,B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
以硼氢化合物NaBH4(强电解质,B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )| A. | 电极a采用MnO2,MnO2既作电极材料又有催化作用 | |
| B. | 电池放电时Na+从b极区移向a极区 | |
| C. | 每消耗3mol H2O2,转移的电子为3mol | |
| D. | 该电池的负极反应为:BH4-+8OH--8e-═BO2-+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠与碳酸氢钙反应 | B. | 过氧化钠与二氧化碳反应 | ||
| C. | 单质硫与氧气反应 | D. | 铁粉与氯气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以上锈蚀过程是发生的化学腐蚀 | |
| B. | 从锈蚀反应的最终结果看,水既是氧化剂.又是还原剂 | |
| C. | 反应的实质是氧气被还原,金属铁被氧化 | |
| D. | 从反应机理看,锈蚀过程发生的是析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(N3-) | B. | c(N${\;}_{3}^{-}$)>c(OH-) | ||
| C. | c(H+)>c(OH-) | D. | c(Na+)=c(N${\;}_{3}^{-}$)+c(HN3) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| 第一组 | Na2CO3 | H2SO4 | NaHCO3 | CaO | CO2 |
| 第二组 | NaOH | HCl | NaCl | Na2O | SO2 |
| 第三组 | NaOH | CH3COOH | CaF2 | Al2O3 | SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com