
硫酸用途十分广泛,工业上合成硫酸时,将SO2转化为催化氧化是一个关键步骤。请回答下列问题:
(1)该反应在恒温恒容密闭容器中进行,判断其达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)某温度下,2SO2(g)+O2(g)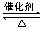 2SO3(g) △H=-196 kJ?mol-1。在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3为0.18 mol,则v(O2)= mol?L-1?min-1,放出的热量为 kJ。
2SO3(g) △H=-196 kJ?mol-1。在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3为0.18 mol,则v(O2)= mol?L-1?min-1,放出的热量为 kJ。
(3)一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示。试分析工业生产中采用常压的原因是 。

(4)将一定量的SO2和0.7 molO2放入一定体积的密闭容器中,在550℃和催化剂作用下发生反应。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。则该反应达到平衡时SO2的转化率是多少?(要写出计算过程,计算结果保留一位小数。)
(1)bc
(2)0.036 17.64
(3)在常压下该反应转化率已很高,若再加压,对设备要求高,同时要消耗大量的能源,不经济。
(4)94.7%
【解析】
试题分析:(1)“变量不变达平衡”,a。反应物和生成物的浓度不变时达平衡,而不是相等,错误;b。SO2百分含量是变量,不变时达到平衡,正确;c.反应是在恒容的容器中进行,反应前后气体的物质的量会发生变化,故容器中气体的压强是变量,正确; d.SO3的生成速率与SO2的消耗速率是同一个方向,一定相等,错误;e.容器体积固定,气体的质量固定,气体的密度是定量,错误;
(2)v(O2)=v (SO3)/2=0.18÷5÷0.5÷2=0.036mol?L-1?min-1,放出的热量为196÷2×0.18=17.64kJ;
(3)在常压下该反应转化率已很高,若再加压,对设备要求高,同时要消耗大量的能源,不经济。
(4)通过过量NaOH溶液,被吸收的为SO2和SO3,物质的量为21.28÷22.4=0.95mol;剩余氧气的量为5.6÷22.4=0.25mol,反应的氧气为0.7-0.25=0.45mol,生成SO3的量为0.45×2=0.9mol;故剩余SO2的量为0.95-0.9=0.05mol,其始量为0.95+0.05=1.00mol,转化率为0.95÷1.00=0.95
考点:考查化学平衡计算及分析的有关问题。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源:2013-2014学年湖南省十三校高三第二次联考理综化学试卷(解析版) 题型:选择题
短周期元素A、B、C、D的原子序数依次增大。A原子的最外层电子数是内层电子数的2倍,元素B在同周期的主族元素中原子半径最大,元素C的合金是日常生活中常用的金属材料,元素D位于第ⅥA族。下列说法正确的是
A.原子半径:D>B>C>A
B.元素A、B的氧化物所含化学键的类型完全相同
C.元素B和C的最高价氧化物对应水化物的碱性:B<C
D.元素B、C、D的最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省景德镇市高三第一次模拟考试卷理综化学试卷(解析版) 题型:填空题
Grignard试剂(卤代烃基镁)广泛运用于有机合成中,Grignard试剂的合成方法是:RX+Mg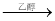 RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
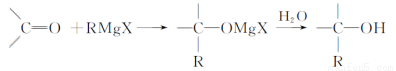
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,该物质具有对称性。合成线路如下:
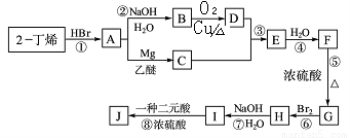
请按要求填空:
(1)用系统命名法对物质B进行命名: ;
(2)在I-J过程中所加入的二元酸的结构简式为: ;
(3)反应①~⑧中属于取代反应的有 个;属于消去反应的有 个.
A.1个 B.2个 C.3个 D.4个
(4)写出下列过程的反应方程式(有机物请用结构简式表示):
B→D ;
I→J ;
(5)写出一种满足以下条件的D的同分异构体的结构简式 。
①能与Na反应反出H2;②核磁共振氢谱有四组峰;③有二种官能团。(注:羟基不能与碳碳双键中的碳原子直接相连)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省南昌市高三3月第一次模拟考试理综化学试卷(解析版) 题型:实验题
无水氯化亚铁用于制造铁系催化剂、印染的媒染剂和染料还原剂,还可用于冶金、医药、照相等行业。一实验小组模仿工业方法制取氯化亚铁,设计装置如下
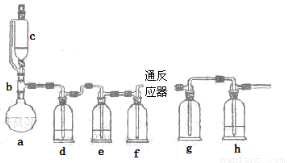
通过查阅相关资料可知:
①在持续高温500℃时,铁与纯净、干燥Cl2反应可生成FeCl2,在温度较低时可生成FeCl3;
②FeCl3熔沸点低,易升华。
根据以上信息回答相关的问题
(1)abc仪器组合成制取氯气的装置,反应无需加热,请写出a容器内所发生的化学反应方程式 。
(2)d、e盛装的药品分别是 和 ,f、g的作用是 。
(3)反应器为硬质玻璃管,纯净铁粉与氯气在500℃左右反应。
①化学反应方程式为
②实验操作顺序是:组装仪器、 、装入药品、 、 、停止加热、关闭c的活塞。
(4)实验小组记录的实验现象如下:
| 观察到的部分现象 |
第一次实验 | 反应器中有白雾、红色固体、g瓶有白雾和黄绿色气体 |
第二次实验 | 反应器中有绿色晶体,g瓶有红棕色的烟和黄绿色气体 |
第三次实验 | 反应器中有绿色晶体,g瓶有黄绿色气体 |
①第一次实验,发现e瓶没有盛装任何药品,所以得到红色固体,其原因是 。
②第二次实验,g瓶有红棕色的烟,其原因是 。
(5)第三次实验得到的固体,最可能含有微量杂质是 ,如果需要配制约2~3mol/L的染料还原剂溶液,则无需除去,理由是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省南昌市高三3月第一次模拟考试理综化学试卷(解析版) 题型:选择题
若两物质恰好完全反应,下列各项中反应前后保持不变的是
①电子总数;②原子总数;③分子总数;④物质的总能量;⑤物质的总质量
A.①②⑤ B.①③⑤ C.②③④ D.②④⑤
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三百校联合调研测试(一)化学试卷(解析版) 题型:选择题
下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
B | 向溶液中先滴加稀盐酸,再滴加BaCl2溶液 | 先滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀 | 溶液中一定含有SO42- |
C | 在0.1 mol·L-1 Na2CO3溶液中,加两滴酚酞显浅红色,微热 | 红色加深 | 盐类水解是吸热反应 |
D | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热 | 无砖红色沉淀生成 | 淀粉没有水解生成葡萄糖 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三百校联合调研测试(一)化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.0.1 mol Cl2全部溶于水后转移电子的数目为0.1NA
B.标准状况下,0.56 L丙烷中含有共价键的数目为0.2NA
C.25℃时,1 L pH=12的Na2CO3溶液中含有Na+的数目为0.02NA
D.常温常压下,14 g C2H4、C3H6的混合气体中含有碳原子的数目为NA
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三年级模拟考试化学试卷(解析版) 题型:选择题
下列说法中正确的是
A. 8NH3(g)+6NO2(g)=7N2(g)+12H2O(g);ΔH<0,则该反应一定能自发进行
B. 提取海带中碘元素时,为将I-完全氧化为I2,用HNO3作氧化剂比用H2O2效果好
C. 原电池放电过程中,负极质量一定减轻,正极的质量一定增加
D. 由于Ksp(MgCO3)<Ksp[Mg(OH)2],因此水垢中MgCO3会逐渐转化为Mg(OH)2
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省韶关市高三4月高考二模理综化学试卷(解析版) 题型:选择题
短周期元素A、B、C、D的原子序数依次增大。A原子的最外层电子数是内层电子数的2倍,元素B在同周期的主族元素中原子半径最大,元素C的合金是日常生活中常用的金属材料,D位于第VIA族。下列说法正确的是
A.原子半径:D>B>C>A
B.元素A、B的氧化物具有相同类型的化学键
C.B、C、D的最高价氧化物对应的水化物能相互反应
D.元素B和C的最高价氧化物对应水化物的碱性:C>B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com