
”¾ĢāÄæ”æX”¢Y”¢Z”¢R”¢W¾łĪŖÖÜĘŚ±ķÖŠĒ°ĖÄÖÜĘŚµÄŌŖĖŲ£¬ĘäŌ×ÓŠņŹżŅĄ“ĪŌö“ó£»X2©ŗĶY+ÓŠĻąĶ¬µÄŗĖĶāµē×ÓÅŲ¼£»ZµÄĒā»ÆĪļµÄ·Šµć±ČĘäÉĻŅ»ÖÜĘŚĶ¬×åŌŖĖŲĒā»ÆĪļµÄ·ŠµćµĶ£»RµÄ»łĢ¬Ō×ÓŌŚĒ°ĖÄÖÜĘŚŌŖĖŲµÄ»łĢ¬Ō×ÓÖŠµ„µē×ÓŹż×ī¶ą£»WĪŖ½šŹōŌŖĖŲ£¬XÓėWŠĪ³ÉµÄijÖÖ»ÆŗĻĪļÓėZµÄĒā»ÆĪļµÄÅØČÜŅŗ¼ÓČČŹ±·“Ó¦æÉÓĆÓŚŹµŃéŹŅÖĘČ”ZµÄĘųĢ¬µ„ÖŹ£®»Ų“šĻĀĮŠĪŹĢā£ØĻą¹Ų»Ų“š¾łÓĆŌŖĖŲ·ūŗűķŹ¾£©£ŗ
£Ø1£©RµÄ»łĢ¬Ō×ÓµÄŗĖĶāµē×ÓÅŲ¼Ź½ŹĒ £®
£Ø2£©ZµÄĒā»ÆĪļµÄ·Šµć±ČĘäÉĻŅ»ÖÜĘŚĶ¬×åŌŖĖŲĒā»ÆĪļµÄ·ŠµćµĶµÄŌŅņŹĒ £®
£Ø3£©XÓėZÖŠµēøŗŠŌ½Ļ“óµÄŹĒ £® ZµÄijÖÖŗ¬ŃõĖįŃĪ³£ÓĆÓŚŹµŃéŹŅÖŠXµÄµ„ÖŹµÄÖĘČ”£¬“ĖĖįøłĄė×ÓµÄæռ乹ŠĶŹĒ £¬ “ĖĄė×ÓÖŠŗ¬ÓŠµÄ»Æѧ¼üĄąŠĶŹĒ £¬ X©Z©XµÄ¼ü½Ē109.5”ć£®£ØĢī”°£¾”±”°=”±»ņ”°£¼”±£©£ØĢįŹ¾£ŗ¹Āµē×Ó¶ŌÖ®¼äµÄ³āĮ¦£¾¹Āµē×Ó¶ŌÓė³É¼üµē×Ó¶ŌÖ®¼äµÄ³āĮ¦£¾³É¼üµē×Ó¶ŌÖ®¼äµÄ³āĮ¦£©£®
£Ø4£©XÓėYŠĪ³ÉµÄ»ÆŗĻĪļY2XµÄ¾§°ūČēĶ¼£®ĘäÖŠXĄė×ÓµÄÅäĪ»ŹżĪŖ £¬ ŅŌĻą¾ąŅ»øöXĄė×Ó×ī½üµÄĖłÓŠYĄė×ÓĪŖ¶„µć¹¹³ÉµÄ¼øŗĪĢåĪŖ £® øĆ»ÆŗĻĪļÓėMgOĻą±Č£¬ČŪµć½ĻøߵďĒ £® 
£Ø5£©ŅŃÖŖøĆ»ÆŗĻĪļµÄ¾§°ū±ß³¤ĪŖa pm£¬ŌņøĆ»ÆŗĻĪļµÄĆܶČĪŖgcm©3 £® £ØÖ»ŅŖĒóĮŠĖćŹ½£¬²»±Ų¼ĘĖć³öŹżÖµ£¬°¢·ü¼ÓµĀĀŽ³£ŹżµÄŹżÖµĪŖNA£©
”¾“š°ø”æ
£Ø1£©1s22s22p63s23p63d54s1
£Ø2£©HF·Ö×Ó¼äÄÜŠĪ³ÉĒā¼ü£¬¶ųHCl·Ö×ÓÖ®¼ä²»“ęŌŚĒā¼ü
£Ø3£©O£»Čż½Ē׶ŠĪ£»¹²¼Ū¼ü£»£¼
£Ø4£©8£»Į¢·½Ģ壻MgO
£Ø5£©![]()
”¾½āĪö”æ½ā£ŗX”¢Y”¢Z”¢R”¢W¾łĪŖÖÜĘŚ±ķÖŠĒ°ĖÄÖÜĘŚµÄŌŖĖŲ£¬ĘäŌ×ÓŠņŹżŅĄ“ĪŌö“ó£¬RµÄ»łĢ¬Ō×ÓŌŚĒ°ĖÄÖÜĘŚŌŖĖŲµÄ»łĢ¬Ō×ÓÖŠµ„µē×ÓŹż×ī¶ą£¬ĖłŅŌRµÄŗĖĶāµē×ÓÅŲ¼Ź½ĪŖ1s22s22p63s23p63d54s1 £¬ ĪŖ24ŗÅøõŌŖĖŲ£¬x2©ŗĶY+ÓŠĻąĶ¬µÄŗĖĶāµē×ÓÅŲ¼£¬ĖłŅŌXŗĶY·Ö±šĪ»ÓŚµŚ¢öA×åŗĶ¢ńA×壬ĒŅXŌŚYµÄÉĻŅ»ÖÜĘŚ£¬ĖłŅŌXY·Ö±šĪŖŃõŗĶÄĘ£¬»ņĮņŗĶ¼Ų£¬XÓėWŠĪ³ÉµÄijÖÖ»ÆŗĻĪļÓėZµÄĒā»ÆĪļµÄÅØČÜŅŗ¼ÓČČŹ±·“Ó¦æÉÓĆÓŚŹµŃéŹŅÖĘČ”ZµÄĘųĢ¬µ„ÖŹ£¬X”¢Y”¢ZµÄŌ×ÓŠņŹż¶¼Š”ÓŚ24£¬ZµÄĒā»ÆĪļµÄ·Šµć±ČĘäÉĻŅ»ÖÜĘŚĶ¬×åŌŖĖŲĒā»ÆĪļµÄ·ŠµćµĶ£¬ĖµĆ÷ZŹĒĮ×”¢Įņ”¢ĀČÖŠµÄijŅ»ÖÖ£¬½įŗĻŌŖĖŲ»ÆŗĻĪļÖŖŹ¶ÖŠŹµŃéŹŅÖĘĀČĘųµÄ·½·Ø£¬æÉÖŖ£¬XĪŖŃõŌŖĖŲ£¬WĪŖĆĢŌŖĖŲ£¬ZĪŖĀČŌŖĖŲ£¬ŌņYĪŖÄĘŌŖĖŲ£¬£Ø1£©øõŹĒ24ŗÅŌŖĖŲ£¬ĖüµÄ»łĢ¬Ō×ÓµÄŗĖĶāµē×ÓÅŲ¼Ź½ŹĒ1s22s22p63s23p63d54s1 £¬ ĖłŅŌ“š°øŹĒ£ŗ1s22s22p63s23p63d54s1£»£Ø2£©HF·Ö×Ó¼äÄÜŠĪ³ÉĒā¼ü£¬¹ŹĘä·Šµć±Č½ĻHCløߣ¬ĖłŅŌ“š°øŹĒ£ŗHF·Ö×Ó¼äÄÜŠĪ³ÉĒā¼ü£¬¶ųHCl·Ö×ÓÖ®¼ä²»“ęŌŚĒā¼ü£»£Ø3£©øł¾ŻĀČŗĶŃõæÉŅŌ“ęŌŚ»ÆŗĻĪļ¶žŃõ»ÆĀČĒŅŃõĻŌ©2¼ŪæÉÖŖ£¬ŃõŌŖĖŲµÄµēøŗŠŌ“óÓŚĀČŌŖĖŲ£¬ZµÄijÖÖŗ¬ŃõĖįŃĪ³£ÓĆÓŚŹµŃéŹŅÖŠXµÄµ„ÖŹµÄÖĘČ”£¬“Ėŗ¬ŃõĖįŃĪĪŖĀČĖį¼Ų£¬“ĖĖįøłĪŖĀČĖįøł£ØClO3©£©£¬ĘäÖŠĀČŌ×ӵļŪ²ćµē×Ó¶ŌŹżĪŖ£ŗ ![]() =4£¬¹Āµē×Ó¶ŌŹżĪŖ1£¬ĖłŅŌClµÄæռ乹ŠĶĪŖČż½Ē׶ŠĪ£¬ĘäÖŠŃõŌ×ÓŗĶĀČŌ×ÓÖ®¼äŹĒ¹²¼Ū¼ü£¬øł¾Ż¼Ū²ćµē×Ó¶Ō»„³āĄķĀŪ£¬¹Āµē×Ó¶ŌÓė¹²ÓƵē×Ó¶ŌµÄÖ®¼äµÄ³āĮ¦“óÓŚ¹²ÓƵē×Ó¶ŌÓė¹²ÓƵē×Ó¶ŌÖ®¼äµÄ³āĮ¦£¬ĖłŅŌClO3©ÖŠO©Cl©O¼üµÄ¼ü½ĒŠ”ÓŚ109.50 £¬ ĖłŅŌ“š°øŹĒ£ŗO£»Čż½Ē׶ŠĪ£»¹²¼Ū¼ü£»£¼£»£Ø4£©Ķ¼ÖŠæÕŠÄĒņµÄøöŹżĪŖ
=4£¬¹Āµē×Ó¶ŌŹżĪŖ1£¬ĖłŅŌClµÄæռ乹ŠĶĪŖČż½Ē׶ŠĪ£¬ĘäÖŠŃõŌ×ÓŗĶĀČŌ×ÓÖ®¼äŹĒ¹²¼Ū¼ü£¬øł¾Ż¼Ū²ćµē×Ó¶Ō»„³āĄķĀŪ£¬¹Āµē×Ó¶ŌÓė¹²ÓƵē×Ó¶ŌµÄÖ®¼äµÄ³āĮ¦“óÓŚ¹²ÓƵē×Ó¶ŌÓė¹²ÓƵē×Ó¶ŌÖ®¼äµÄ³āĮ¦£¬ĖłŅŌClO3©ÖŠO©Cl©O¼üµÄ¼ü½ĒŠ”ÓŚ109.50 £¬ ĖłŅŌ“š°øŹĒ£ŗO£»Čż½Ē׶ŠĪ£»¹²¼Ū¼ü£»£¼£»£Ø4£©Ķ¼ÖŠæÕŠÄĒņµÄøöŹżĪŖ ![]() =4£¬ŹµŠÄĒņµÄøöŹżĪŖ8£¬ĖłŅŌæÕŠÄĒņ“ś±ķŃõĄė×Ó£¬ŹµŠÄĒņ“ś±ķÄĘĄė×Ó£¬øł¾ŻNa2OµÄ¾§°ū½į¹¹Ķ¼æÉÖŖ£¬ŃõĄė×ÓÖÜĪ§×ī½üµÄÄĘĄė×ÓøöŹżĪŖ8øö£¬ŅŌĻą¾ąŅ»øöŃõĄė×Ó×ī½üµÄĖłÓŠÄĘĄė×ÓĪŖ¶„µć¹¹³ÉµÄ¼øŗĪĢåĪŖĮ¢·½Ģ壬ÓÉÓŚÄĘĄė×ӵİė¾¶“óÓŚĆ¾Ąė×Ó£¬ĖłŅŌŌŚŃõ»ÆÄĘÖŠµÄ¾§øńÄÜŠ”ÓŚŃõ»ÆĆ¾£¬ĖłŅŌŃõ»ÆĆ¾µÄČŪµćøßÓŚŃõ»ÆÄĘ£¬ĖłŅŌ“š°øŹĒ£ŗ8£»Į¢·½Ģ壻MgO£»£Ø5£©øł¾Ż¾łĢÆ·ØæÉÖŖ£¬ŌŚĆæøöNa2OµÄ¾§°ūÖŠŗ¬ÓŠÄĘĄė×ÓŹżĪŖ8£¬ŗ¬ÓŠŃõĄė×ÓŹżĪŖ
=4£¬ŹµŠÄĒņµÄøöŹżĪŖ8£¬ĖłŅŌæÕŠÄĒņ“ś±ķŃõĄė×Ó£¬ŹµŠÄĒņ“ś±ķÄĘĄė×Ó£¬øł¾ŻNa2OµÄ¾§°ū½į¹¹Ķ¼æÉÖŖ£¬ŃõĄė×ÓÖÜĪ§×ī½üµÄÄĘĄė×ÓøöŹżĪŖ8øö£¬ŅŌĻą¾ąŅ»øöŃõĄė×Ó×ī½üµÄĖłÓŠÄĘĄė×ÓĪŖ¶„µć¹¹³ÉµÄ¼øŗĪĢåĪŖĮ¢·½Ģ壬ÓÉÓŚÄĘĄė×ӵİė¾¶“óÓŚĆ¾Ąė×Ó£¬ĖłŅŌŌŚŃõ»ÆÄĘÖŠµÄ¾§øńÄÜŠ”ÓŚŃõ»ÆĆ¾£¬ĖłŅŌŃõ»ÆĆ¾µÄČŪµćøßÓŚŃõ»ÆÄĘ£¬ĖłŅŌ“š°øŹĒ£ŗ8£»Į¢·½Ģ壻MgO£»£Ø5£©øł¾Ż¾łĢÆ·ØæÉÖŖ£¬ŌŚĆæøöNa2OµÄ¾§°ūÖŠŗ¬ÓŠÄĘĄė×ÓŹżĪŖ8£¬ŗ¬ÓŠŃõĄė×ÓŹżĪŖ ![]() =4£¬ĖłŅŌŅ»øö¾§°ūµÄÖŹĮæĪŖ
=4£¬ĖłŅŌŅ»øö¾§°ūµÄÖŹĮæĪŖ ![]() g£¬Na2OµÄĆܶČĪŖ£ŗ
g£¬Na2OµÄĆܶČĪŖ£ŗ 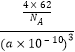 =
= ![]() £¬
£¬
ĖłŅŌ“š°øŹĒ£ŗ ![]() £®
£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŅĒĘ÷ÖŠ£¬¾ßÓŠÄÜČܽā¹ĢĢ唢ÅäÖĘČÜŅŗ”¢¼ÓČČ½Ļ¶ąŹŌ¼ĮČżÖÖÓĆĶ¾µÄŹĒ
A. ČŻĮæĘæ B. ÉÕ± C. ĮæĶ² D. ŹŌ¹Ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻÖÓŠA”¢B”¢C”¢DĖÄÖÖŌŖĖŲ£¬ĘäŌ×ÓŠņŹżŅĄ“ĪµŻŌö£®ŅŃÖŖ£¬A”¢CĪŖ¶ĢÖÜĘŚ·Ē½šŹōŌŖĖŲ£¬Ę䵄֏ŌŚ³£ĪĀĻĀ¾łĪŖĘųĢ壬Į½µ„ÖŹ»ģŗĻ¼ū¹ā±¬ÕØÉś³ÉAC£¬ACČÜŅŗĻŌĒæĖįŠŌ£®B”¢DĪŖ½šŹōŌŖĖŲ£¬BµÄŌ×ÓŠņŹżĪŖDµÄŅ»°ė£¬DÓėC2ŗĶACČÜŅŗ·“Ó¦·Ö±šµĆDC3ŗĶDC2 £¬ ÉÕ¼īČÜŅŗ²»ÄÜÓėDµ„ÖŹ·“Ó¦£¬¶ųÄÜÓėBµ„ÖŹ·“Ó¦£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©CµÄŌ×Ó½į¹¹Ź¾ŅāĶ¼ĪŖ£»BŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆŹĒ ”£
£Ø2£©ÓƵē×ÓŹ½±ķŹ¾ACµÄŠĪ³É¹ż³Ģ ”£
£Ø3£©Š“³öBµ„ÖŹÓėNaOHČÜŅŗ·“Ó¦µÄĄė×Ó·½³ĢŹ½ ”£
£Ø4£©µēø”єĿ¾Ū·ØŹĒ¹¤ŅµÉĻ²ÉÓƵÄŅ»ÖÖĪŪĖ®“¦Ąķ·½·Ø£¬ÓŅĶ¼ŹĒøĆ·½·Ø“¦ĄķĪŪĖ®µÄŹµŃé×°ÖĆŹ¾ŅāĶ¼£ØB”¢D½šŹōµ„ÖŹ×÷µē¼«£©£®ŹµŃé¹ż³ĢÖŠ£¬ĪŪĖ®µÄpHŹ¼ÖÕ±£³ÖŌŚ5.0”«6.0Ö®¼ä£®½ÓĶصēŌ“ŗó£¬Ņõ¼«²śÉśµÄĘųĢ彫ĪŪĪļ“ųµ½Ė®ĆęŠĪ³Éø”Ōü¶ų¹ĪČ„£¬Ęšµ½ø”Ń”¾»»Æ×÷ÓĆ£»Ńō¼«²śÉśµÄ³Įµķ¾ßÓŠĪüø½ŠŌ£¬Īüø½ĪŪĪļ¶ų³Į»ż£¬Ęšµ½Äż¾Ū¾»»Æ×÷ÓĆ£®Ńō¼«µÄµē¼«·“Ó¦ÓŠĮ½øö£¬·Ö±šŹĒ2H2O-4e-=4H++O2”üŗĶ ”£Ńō¼«ĒųÉś³É³ĮµķµÄĄė×Ó·½³ĢŹ½ŹĒ”£ 
£Ø5£©Ņ»¶ØĢõ¼žĻĀ£¬2mol BÓė3mol DµÄŃõ»ÆĪļWĒ”ŗĆ·“Ó¦£¬ŌņWµÄ»ÆѧŹ½”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĶ¬Ń§ÓĆĻĀĮŠ×°ÖĆÖʱø²¢¼ģŃéCl2µÄŠŌÖŹ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ(””””) 
A.¢ńĶ¼ÖŠ£ŗČē¹ūMnO2¹żĮ棬ÅØŃĪĖį¾ĶæÉČ«²æĻūŗÄ
B.¢ņĶ¼ÖŠ£ŗŹŖČóµÄÓŠÉ«²¼ĢõÄÜĶŹÉ«£¬½«ĮņĖįČÜŅŗµĪČėÉÕ±ÖŠ£¬ÖĮČÜŅŗĻŌĖįŠŌ£¬½į¹ūÓŠCl2Éś³É
C.¢óĶ¼ÖŠ£ŗÉś³ÉĄ¶É«µÄŃĢ
D.¢ōĶ¼ÖŠ£¬ĮæĶ²ÖŠ·¢ÉśĮĖ¼Ó³É·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ£Ø1£©¹ż¶É½šŹōŌŖĖŲĢśÄÜŠĪ³É¶ąÖÖÅäŗĻĪļ£¬Čē£ŗ[Fe£ØH2NCONH2£©6]£ØNO3£©3[ČżĻõĖįĮłÄņĖŲŗĻĢś£Ø¢ó£©]ŗĶFe£ØCO£©xµČ£®
¢Ł»łĢ¬Fe3+µÄM²ćµē×ÓÅŲ¼Ź½ĪŖ”” ””£®
¢ŚÅäŗĻĪļFe£ØCO£©xµÄÖŠŠÄŌ×Ó¼Ūµē×ÓŹżÓėÅäĢåĢį¹©µē×ÓŹżÖ®ŗĶĪŖ18£¬Ōņx= ””£® Fe£ØCO£©x³£ĪĀĻĀ³ŹŅŗĢ¬£¬ČŪµćĪŖ©20.5”ę£¬·ŠµćĪŖ103”ę£¬Ņ×ČÜÓŚ·Ē¼«ŠŌČܼĮ£¬¾Ż“ĖæÉÅŠ¶ĻFe£ØCO£©x¾§ĢåŹōÓŚ £ØĢī¾§ĢåĄąŠĶ£©£»
£Ø2£©OŗĶNaŠĪ³ÉµÄŅ»ÖÖÖ»ŗ¬ÓŠĄė×Ó¼üµÄĄė×Ó»ÆŗĻĪļµÄ¾§°ū½į¹¹ČēĶ¼£¬¾ąŅ»øöŅõĄė×ÓÖÜĪ§×ī½üµÄĖłÓŠŃōĄė×ÓĪŖ¶„µć¹¹³ÉµÄ¼øŗĪĢåĪŖ £® ŅŃÖŖøĆ¾§°ūµÄĆܶČĪŖ¦Ń g/cm3 £¬ °¢·ü¼ÓµĀĀŽ³£ŹżĪŖNA £¬ Ē󾧰ū±ß³¤a=”” ””cm£®£ØÓĆŗ¬¦Ń”¢NAµÄ¼ĘĖćŹ½±ķŹ¾£©
£Ø3£©ĻĀĮŠÓŠ¹ŲµÄĖµ·ØÕżČ·µÄŹĒ”” ””£®
A£®µŚŅ»µēĄėÄܓ󊔣ŗS£¾P£¾Si
B£®µēøŗŠŌĖ³Šņ£ŗC£¼N£¼O£¼F
C£®ŅņĪŖ¾§øńÄÜCaO±ČKCløߣ¬ĖłŅŌKCl±ČCaOČŪµćµĶ
D£®SO2ÓėCO2µÄ»ÆѧŠŌÖŹĄąĖĘ£¬·Ö×Ó½į¹¹Ņ²¶¼³ŹÖ±ĻߊĶ£¬ĻąĶ¬Ģõ¼žĻĀSO2µÄČܽā¶Čøü“ó
E£®·Ö×Ó¾§ĢåÖŠ£¬¹²¼Ū¼ü¼üÄÜŌ½“ó£¬øĆ·Ö×Ó¾§ĢåµÄČŪ·ŠµćŌ½øß
£Ø4£©Ō×ÓŠņŹżŠ”ÓŚ36µÄX”¢Y”¢Z”¢WĖÄÖÖŌŖĖŲ£¬ĘäÖŠXŹĒŠĪ³É»ÆŗĻĪļÖÖĄą×ī¶ąµÄŌŖĖŲ£¬YŌ×Ó»łĢ¬Ź±×īĶā²ćµē×ÓŹżŹĒĘäÄŚ²ćµē×ÓŹżµÄ2±¶£¬ZŌ×Ó»łĢ¬Ź±2pŌ×Ó¹ģµĄÉĻÓŠ3øöĪ“³É¶ŌµÄµē×Ó£¬WµÄŌ×ÓŠņŹżĪŖ29£®»Ų“šĻĀĮŠĪŹĢā£ŗ
¢ŁY2X2·Ö×ÓÖŠYŌ×Ó¹ģµĄµÄŌÓ»ÆĄąŠĶĪŖ”” £¬ 1mol Y2X2ŗ¬ÓŠ¦Ņ¼üµÄŹżÄæĪŖ””
¢Ś»ÆŗĻĪļZX3µÄ·Šµć±Č»ÆŗĻĪļYX4µÄøߣ¬ĘäÖ÷ŅŖŌŅņŹĒ”” £®
¢ŪŌŖĖŲYµÄŅ»ÖÖŃõ»ÆĪļÓėŌŖĖŲZµÄŅ»ÖÖŃõ»ÆĪļ»„ĪŖµČµē×ÓĢ壬ŌŖĖŲZµÄÕāÖÖŃõ»ÆĪļµÄ·Ö×ÓŹ½ŹĒ”” ””£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄ³Ń§ÉśŅŌĢśĖæŗĶCl2ĪŖŌĮĻ½ųŠŠĻĀĮŠČżøöŹµŃ飮“Ó·ÖĄą½Ē¶Č·ÖĪö£¬ĻĀĮŠŃ”ĻīÕżČ·µÄŹĒ£Ø””””£© 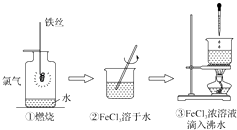
A.ŹµŃé¢Ł”¢¢ŚĖłÉę¼°µÄĪļÖŹ¾łĪŖµē½āÖŹ
B.ŹµŃé¢Ś”¢¢Ū¾łĪŖ·ÅČČ·“Ó¦ŹµŃé
C.¢Ś”¢¢Ū¾łĪ“·¢ÉśŃõ»Æ»¹Ō·“Ó¦
D.ŹµŃé¢Ł”¢¢Ū·“Ó¦ÖʵƵÄĪļÖŹ¾łĪŖ“æ¾»Īļ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»Æѧ·“Ó¦ŌĄķŌŚæĘŃŠŗĶÉś²śÖŠÓŠ¹ć·ŗÓ¦ÓĆ”£
£Ø1£©ÓĆÉśĪļÖŹČČ½āĘų(Ö÷ŅŖ³É·ÖĪŖCO”¢CH4”¢H2)½«SO2ŌŚŅ»¶ØĢõ¼žĻĀ»¹ŌĪŖµ„ÖŹĮņ½ųŠŠŃĢĘųĶŃĮņ”£ŅŃÖŖ£ŗ
¢ŁC(s)+O2(g)=CO2(g) ”÷H1=-393.5 kJ”¤mol-1
¢ŚCO2(g)+C(s)=2CO(g) ”÷H2= + 172.5 kJ”¤mol-1
¢ŪS(s)+O2(g)=SO2(g) ”÷H3=- 296.0 kJ”¤mol-1
CO½«SO2 »¹ŌĪŖµ„ÖŹĮņµÄČČ»Æѧ·½³ĢŹ½ĪŖ_____________________________________”£
£Ø2£©COæÉÓĆÓŚŗĻ³É¼×“¼£¬Ņ»¶ØĪĀ¶ČĻĀ£¬ĻņĢå»żĪŖ2 LµÄĆܱÕČŻĘ÷ÖŠ¼ÓČėCOŗĶH2£¬·¢Éś·“Ó¦CO(g)+2H2(g)![]() CH3OH(g)£¬“ļµ½Ę½ŗāŗó²āµĆø÷×é·ÖµÄÅضČČēĻĀ£ŗ
CH3OH(g)£¬“ļµ½Ę½ŗāŗó²āµĆø÷×é·ÖµÄÅضČČēĻĀ£ŗ
ĪļÖŹ | CO | H2 | CH3OH |
ÅØ¶Č£Ømol”¤L-1£© | 0.9 | 1.0 | 0.6 |
¢Ł·“Ó¦“ļµ½Ę½ŗāŹ±£¬COµÄ×Ŗ»ÆĀŹĪŖ_______________”£
¢ŚøĆ·“Ó¦µÄĘ½ŗā³£ŹżK=________________”£
¢ŪŗćĪĀŗćČŻĢõ¼žĻĀ£¬æÉŅŌĖµĆ÷·“Ó¦ŅŃ“ļµ½Ę½ŗāדĢ¬µÄŹĒ__________(Ģī±źŗÅ)”£
A£®vÕż(CO)=2vÄę(H2) B£®»ģŗĻĘųĢåµÄĆÜ¶Č²»±ä
C£®»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»±ä D£®CH3OH”¢CO”¢H2µÄÅØ¶Č¶¼²»ŌŁ·¢Éś±ä»Æ
¢ÜČō½«ČŻĘ÷Ģå»żŃ¹Ėõµ½1L£¬Ōņ“ļµ½ŠĀĘ½ŗāŹ±c(H2)µÄȔֵ·¶Ī§ŹĒ_____________”£
¢ŻČō±£³ÖČŻĘ÷Ģå»ż²»±ä£¬ŌŁ³äČė0.6molCOŗĶ0.4molCH3OH£¬“ĖŹ±vÕż__________vÄę(Ģī”°>”±<”±»ņ”°=”±)”£
£Ø3£©³£ĪĀĻĀ£¬HNO2µÄµēĄė³£ŹżKa=7.1”Į10-4mol”¤L-1£¬NH3”¤H2OµÄµēĄė³£ŹżKb=1.7”Į10-5mol”¤L-1”£0.1mol”¤L-1NH4NO2ČÜŅŗÖŠĄė×ÓÅضČÓɓ󵽊”µÄĖ³ŠņŹĒ__________£¬³£ĪĀĻĀNO2-Ė®½ā·“Ó¦µÄĘ½ŗā³£ŹżKb=__________(±£ĮōĮ½Ī»ÓŠŠ§Źż×Ö)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČēĶ¼ĖłŹ¾×°ÖĆæÉÓĆĄ“ÖĘČ”Fe£ØOH£©2ŗĶ¹Ū²ģFe£ØOH£©2ŌŚæÕĘųÖŠ±»Ńõ»ÆŹ±µÄŃÕÉ«±ä»Æ£®ŹµŃéĢį¹©µÄŹŌ¼Į£ŗĢśŠ¼”¢6mol/LĮņĖįČÜŅŗ”¢NaOHČÜŅŗ£®ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ£Ø £©

A. BÖŠŹ¢ÓŠŅ»¶ØĮæµÄNaOHČÜŅŗ£¬AÖŠÓ¦Ō¤ĻČ¼ÓČėµÄŹŌ¼ĮŹĒĢśŠ¼
B. ŹµŃéæŖŹ¼Ź±Ó¦ĻČ½«»īČūE¹Ų±Õ
C. Éś³ÉFe£ØOH£©2µÄ²Ł×÷ĪŖ£ŗ¹Ų±ÕE£¬Ź¹AÖŠČÜŅŗŃ¹ČėBĘæÖŠ
D. Č”ĻĀ×°ÖĆBÖŠµÄĻšĘ¤Čū£¬Ź¹æÕĘų½ųČė£¬ŃÕÉ«±ä»ÆĪŖ°×É«±ä³É»ŅĀĢÉ«£¬×īÖÕ±ä³ÉŗģŗÖÉ«
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖŃõ»ÆŠŌ£ŗCl2£¾Fe3+£¾I2£¾S£¬ŌŚĒæĖįŠŌČÜŅŗÖŠ£¬ĻĀĮŠø÷×éĄė×ÓÄÜ“óĮæ¹²“ęµÄŹĒ£Ø””””£©
A.Na+”¢K+”¢I©”¢Cl©B.Na+”¢I©”¢SO42©”¢Fe3+
C.Ba2+”¢K+”¢HCO3©”¢NO3©D.Ba2+”¢Na+”¢SO42©”¢Cl©
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com