
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| [CO2]/mol•L-1 | [H2]/mol•L-1 | [CH4]/mol•L-1 | [H2O]/mol•L-1 | |
| 平衡Ⅰ | a | b | c | d |
| 平衡Ⅱ | m | n | x | y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 中国是中草药的发源地,目前中国大约有12000种药用植物,从某中草药提取的有机物结构如图所示,该有机物的下列说法中不正确的是( )
中国是中草药的发源地,目前中国大约有12000种药用植物,从某中草药提取的有机物结构如图所示,该有机物的下列说法中不正确的是( )| A. | 分子式为C14H18O6 | |
| B. | 环上氢原子的一氯取代物5种 | |
| C. | 1mol该有机物与足量的金属钠反应产生4mol H2 | |
| D. | 分子间能发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将5.85 g NaCl固体溶于1 L水中可配成0.1mol/L的NaCl 溶液 | |
| B. | 500 ml 0.5mol/L 的NaOH溶液含NaOH分子0.25 mol | |
| C. | 把200mL 3mol/L的BaCl2溶液跟100mL 3mol/L的KCl溶液混合后,溶液中的c(Cl-)仍然是3mol/L(忽略混合后体积变化) | |
| D. | 把100g 20%的NaCl溶液跟100g H2O混合后,NaCl溶液的质量分数是10% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
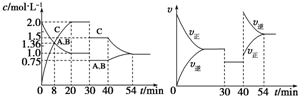
| A. | 30~40 min 间该反应使用了催化剂 | |
| B. | 反应方程式中的x=1,正反应为吸热反应 | |
| C. | 30 min 时降低温度,40 min 时升高温度 | |
| D. | 30 min时减小压强,40 min时升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是置换反应 | B. | 该反应中FeCl3作还原剂 | ||
| C. | 还原性:Cu>Fe2+ | D. | 氧化性:CuCl2>FeCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com