
【题目】给你提供纯锌、纯铜片和500 mL 0.2 mol·L-1的H2SO4溶液、导线、1000 mL量筒。试用下图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量。

(1)如图所示,装置气密性良好,且1000 mL量筒中已充满了水,则开始实验时,a电极材料为________,其电极反应式为________。b电极材料为________,其电极反应式为________。
(2)当量筒中收集到672 mL气体时(已折算到标准状况下),通过导线的电子的物质的量为__________。
【答案】纯锌片 Zn-2e-=Zn2+ 纯铜片 2H++2e-=H2↑ 0.06 mol
【解析】
(1)活泼失电子的金属锌作负极,发生氧化反应,铜作正极,发生还原反应;
(2)根据电极反应式进行计算;
(1)锌、铜、硫酸原电池中,纯锌片是负极,电极反应:Zn-2e-=Zn2+,铜是正极,该极上电极反应为:2H++2e-=H2↑,该装置右侧放出H2,则b电极材料为纯铜片,故答案为:纯锌片;Zn-2e-=Zn2+;纯铜片;2H++2e-=H2↑;
(2)正极上电极反应为:2H++2e-=H2↑,当量筒中收集到672ml即标况下0.03mol氢气时,转移电子是0.06mol,故答案为:0.06mol。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】欲测定金属镁的相对原子质量,请利用下图给定的仪器组成一套实验装置(每个仪器只能使用一次,假设气体的体积可看作标准状况下的体积)。

填写下列各项(气流从左到右):
(1)各种仪器连接的先后顺序是__________接________、________接________、________接________、________接________(用小写字母表示)。
(2)连接好仪器后,要进行的操作有以下几步,其先后顺序是________________(填序号)。
①待仪器B中的温度恢复至室温时,测得量筒C中水的体积为Va mL;
②擦掉镁条表面的氧化膜,将其置于天平上称量,得质量为m g,并将其投入试管B中的带孔隔板上;
③检查装置的气密性;
④旋开装置A上分液漏斗的活塞,使其水顺利流下,当镁完全溶解时再关闭这个活塞,这时A中共放入水Vb mL。
(3)根据实验数据可算出金属镁的相对原子质量,其数学表达式为___________________。
(4)若试管B的温度未冷却至室温,就读出量筒C中水的体积,这将会使所测定镁的相对原子质量数据________(填“偏大”“偏小”或“无影响”)。
(5)仔细分析上述实验装置后,经讨论认为结果会有误差,于是又设计了如下图所示的实验装置。

①装置中导管a的作用是_________________________________________。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为____________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的有机化工原料,可由乙醇脱水制备。涉及反应如下:
①2CH3OH(g)![]() CH3OCH3(g)+ H2O(g) △H1=—23.9 kJmol-1
CH3OCH3(g)+ H2O(g) △H1=—23.9 kJmol-1
②2CH3OH(g)![]() C2H4(g)+2H2O(g) △H2= —29.1kJmol-1
C2H4(g)+2H2O(g) △H2= —29.1kJmol-1
③CH3CH2OH(g)![]() CH3OCH3(g) △H3= +50.7kJmol-1
CH3OCH3(g) △H3= +50.7kJmol-1
④C2H5OH(g)![]() C2H4(g)+ H2O(g) △H4=akJmol-1
C2H4(g)+ H2O(g) △H4=akJmol-1
回答下列问题:
(1)a=___________。
(2)在1.0L密闭容器中放入0.10 mol C2H5OH(g),在一定温度下进行④反应,反应时间(t)与容器内气体总压强(P)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强P/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
①欲提高C2H5OH的平衡转化率,应采取的措施为___________(填字母)。
a.升高温度 b.增大压强
c.通入乙醇 d.降低压强
②由总压强P和起始压强P0计算反应物C2H5OH的转化率(C2H5OH)的表达式为_________,平衡时C2H5OH的转化率为_______(结果保留两位有效数字,下同),该反应的平衡常数K=_________。
③用总压强P和起始压强P0表示反应体系的总物质的量n(总)和反应物C2H5OH的物 质的量n(C2H5OH),n(总)=_____mol,n(C2H5OH)=_____mol。
(3)下表为反应④中反应物浓度与反应时间的数据,分析该反应中c(C2H5OH)变化与时间间隔(△t)的规律,得出的结论是______,由此规律推出反应在12h时c(C2H5OH)等于______molL-1
反应时间t/h | 0 | 4 | 8 | 16 |
c(C2H5OH)/(molL-1) | 0.10 | 0.051 | 0.026 | 0.0065 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:2SO2+O2![]() 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入下表空格内(填“增大”“减小”或“不变”)。
2SO3(g),当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入下表空格内(填“增大”“减小”或“不变”)。
编号 | 改变的条件 | 生成SO3速率 |
① | 升高温度 | ________ |
② | 降低温度 | ________ |
③ | 增大氧气浓度 | ________ |
④ | 使用催化剂 | ________ |
⑤ | 压缩体积 | ________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 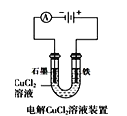 中阳极处能产生使湿润淀粉KI试纸变蓝的气体
中阳极处能产生使湿润淀粉KI试纸变蓝的气体
B. 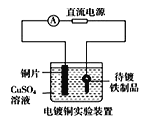 中待镀铁制品应与电源正极相连
中待镀铁制品应与电源正极相连
C. 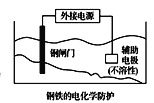 中钢闸门应与外接电源的正极相连,称为牺牲阳极的阴极保护法
中钢闸门应与外接电源的正极相连,称为牺牲阳极的阴极保护法
D. 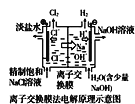 中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠硫电池体积小、容量大、寿命长、效率高,在电力储能中广泛应用于削峰填谷、应急电源、风力发电等储能方面。Na-S电池的结构如下图所示,电池反应为2Na+![]() S8=Na2Sn。下列说法不正确的是( )
S8=Na2Sn。下列说法不正确的是( )
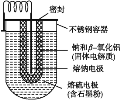
A. 熔钠电极作电池的负极B. 放电时Na+向正极移动
C. 充电时熔钠电极与电源的正极相连D. 充电时阳极反应式为8Sn2--16e-=nS8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,能一步实现如图所示各步转化关系的是( )

选项 | X | Y | Z | W |
A | Fe3O4 | Fe | FeCl2 | FeCl3 |
B | Al | Al2O3 | NaAlO2 | Al(OH)3 |
C | NH3 | NO | NO2 | HNO3 |
D | Si | SiO2 | H2SiO3 | Na2SiO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A、B的分子式均为C10H10O5,均能发生如下变化。
已知:
1.A、B、C、D均能与NaHCO3反应
2.只有A、D能与FeCl3溶液发生显色反应,A苯环上的一溴代物只有两种
3.F能使溴水褪色
4.H不能发生银镜反应
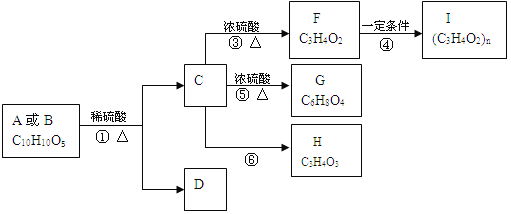
根据题意回答下列问题:
(1)反应③的反应类型是_____;有机物F含氧官能团的名称是_____。
(2)写出有机物的结构简式A__________、H_________。
(3)写出反应⑤的化学方程式_______________。
(4)D的同分异构体有很多种,写出同时满足下列要求的所有同分异构体的结构简式:____。
①能与FeCl3溶液发生显色反应 ②能发生银镜反应但不能水解 ③苯环上的一卤代物只有2种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com