
| A. | 500mL,0.2mol/L 的NaCl溶液 | B. | 1 000 mL,0.1mol/L 的MgCl2溶液 | ||
| C. | 50 mL,0.2mol/L 的CaCl2溶液 | D. | 100 mL,0.1mol/L 的AlCl3溶液 |
分析 结合溶质的物质的量浓度及物质构成计算氯离子的浓度,以此来解答.
解答 解:A.0.2mol/L 的NaCl溶液中Cl-浓度为0.2mol/L;
B.0.1mol/L 的MgCl2溶液中Cl-浓度为0.1mol/L×2=0.2mol/L;
C..2mol/L 的CaCl2溶液中Cl-浓度为0.2mol/L×2=0.4mol/L;
D.1mol/L 的AlCl3溶液中Cl-浓度为0.1mol/L×3=0.3mol/L,
显然C中最大,
故选C.
点评 本题考查物质的量浓度的计算,为高频考点,把握物质的构成、溶质浓度与离子浓度关系为解答的关键,侧重分析与计算能力的考查,注意与溶液体积无关,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性强弱:HI>HBr>HCl>HF | B. | 还原性强弱:F->Cl->I- | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 原子半径大小:Na>S>O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4++H2O?NH3•H2O+H+ | B. | Fe3++3H2O═Fe(OH)3↓+3H+ | ||
| C. | S2-+2H2O═H2S+2OH- | D. | Br-+H2O═HBr+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
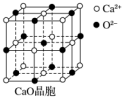 可以由下列反应合成三聚氰胺:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑,CaC2+N2$\frac{\underline{\;高温\;}}{\;}$CaCN2+C,CaCN2+2H2O═NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺.
可以由下列反应合成三聚氰胺:CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑,CaC2+N2$\frac{\underline{\;高温\;}}{\;}$CaCN2+C,CaCN2+2H2O═NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺.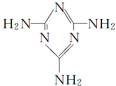 )俗称“蛋白精”,三聚氰酸(
)俗称“蛋白精”,三聚氰酸( 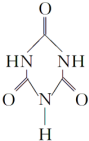 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | v(B2)=0.9mol/(L•s) | B. | v(A2)=0.5mol/(L•s) | ||
| C. | v(C)=0.62mol/(L•s) | D. | v(B2)=90.0mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
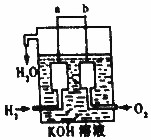 氢气被公认是21世纪替代矿物燃料的理想能源.请回答下列问题
氢气被公认是21世纪替代矿物燃料的理想能源.请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:推断题
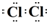 ,该反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
,该反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com