
| A. | 两个反应均为氧化还原反应 | |
| B. | CO2与SO2不能用澄清石灰水鉴别 | |
| C. | CO2分子中各原子最外层均为8电子稳定结构 | |
| D. | 相同条件下:2CO(g)+SO2(g)=S(g)+2CO2(g)△H=+270kJ/mol |
分析 ①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)中C、O元素的化合价变化,②S(g)+O2(g)=SO2(g)中S、O元素的化合价变化,二氧化碳、二氧化硫均与石灰水反应生成白色沉淀,二氧化碳中存在C=O键,由盖斯定律可知①×2-②得到2CO(g)+SO2(g)=S(g)+2CO2(g),以此来解答.
解答 解:A.均含元素的化合价变化,均为氧化还原反应,故A正确;
B.二氧化碳、二氧化硫均与石灰水反应生成白色沉淀,不能鉴别,故B正确;
C.由O=C=O可知,各原子最外层均为8电子稳定结构,故C正确;
D.①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ/mol,②S(g)+O2(g)=SO2(g)△H=-296.0kJ/mol,由盖斯定律可知①×2-②得到2CO(g)+SO2(g)=S(g)+2CO2(g),△H=(-283.0kJ/mol)×2-(-296.0kJ/mol)=-270kJ/mol,故D错误;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意选项D为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若混合后溶液pH=7,则c(M+)=c(Cl-) | |
| B. | 若b=2a,则c(Cl-)>c(M+)>c(H+)>c(OH-) | |
| C. | 若a=2b,则c(M+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 若混合后溶液满足c(H+)=c(OH-)+c(MOH),则可推出a=b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | 密度/g•cm-3 | 沸点/℃ | 溶解性 |
| 正丁醇 | 0.810 | 118.0 | 可溶 |
| 冰醋酸 | 1.049 | 118.1 | 互溶 |
| 乙酸正丁酯 | 0.882 | 126.1 | 微溶 |
| 乙醇 | 0.79 | 78.5 | 互溶 |
| 乙酸乙酯 | 0.88 | 77.06 | 可溶 |
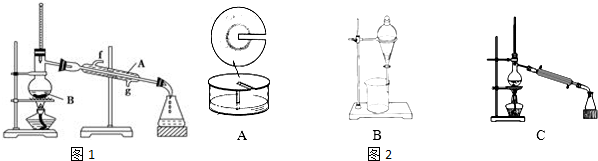
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、R、D都是周期表中前四周期的元素,它们的原子序数依次增大.其中A元素基态原子第一电离能比B元素基态原子的第一电离能大,B的基态原子的L层、R基态原子的M层均有2个单电子,D是第Ⅷ族中原子序数最小的元素.
已知A、B、R、D都是周期表中前四周期的元素,它们的原子序数依次增大.其中A元素基态原子第一电离能比B元素基态原子的第一电离能大,B的基态原子的L层、R基态原子的M层均有2个单电子,D是第Ⅷ族中原子序数最小的元素.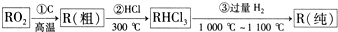
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
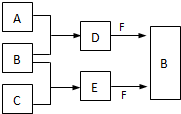 A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图(反应条件和部分产物略去).试回答:
A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图(反应条件和部分产物略去).试回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯可作为水果的催熟剂 | |
| B. | 用食醋可除去热水壶内壁的水垢 | |
| C. | 烹鱼时加适量醋和酒可以增加香味 | |
| D. | 医用酒精消毒是利用其氧化性使蛋白质变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
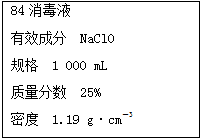 已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:
已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com