
���� ��1�������м��̬�������������ԣ�Ҳ�л�ԭ�ԣ�
��2�����ݷ�Ӧ��Ϊ������̼���������ӣ�������Ϊ����������ȩ���ж϶�����̼�ڷ�Ӧ�е����ã�Ȼ��д����Ӧ�����ӷ���ʽ��
��� �⣺��1��+2��ΪFeԪ�ص��м��̬�������������Ӽ��������ԣ�Ҳ�л�ԭ�ԣ��ʴ�Ϊ��A��
��2��CH2O��̼Ԫ�ػ��ϼ�Ϊ0����Ӧ�������̼��̼Ԫ�ػ��ϼ�Ϊ+4��˵��������̼���ϼ۽��ͱ���ԭ����Ӧ��������������Fe2+����ԭ������Fe2O3�����ݵ�ʧ�����غ㡢����غ㼰ԭ���غ㣬��Ӧ�����ӷ���ʽΪ��CO2+4Fe2++5H2O=CH2O+2Fe2O3+8H+��
�ʴ�Ϊ��1��4Fe2+��5��1��2Fe2O3��8��
���� ���⿼��������ԭ��Ӧ��Ϊ�߿���Ƶ���㣬���շ�Ӧ��Ԫ�صĻ��ϼ۱仯Ϊ���Ĺؼ�������������ԭ��Ӧ���������ת�Ƶ��ӵĿ��飬��Ŀ�ѶȲ���


 һ����ʦ�����Ծ�ϵ�д�
һ����ʦ�����Ծ�ϵ�д� �����Ծ���Ԫ���Ծ�ϵ�д�
�����Ծ���Ԫ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 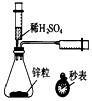 �ⶨһ��ʱ��������H2�ķ�Ӧ���� | B�� | 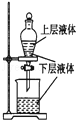 ��ȡ�����еĵ� | ||
| C�� | 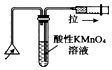 ������ȼ�ղ�����SO2 | D�� | 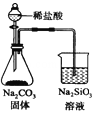 ֤���ǽ����ԣ�Cl��C��Si |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
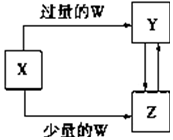 ��֪X��Y��Z��W��Ϊ��ѧ��ѧ�г����ĵ��ʻ������֮���ת����ϵ��ͼ��ʾ�����ֲ�������ȥ������W��X�������ǣ�������
��֪X��Y��Z��W��Ϊ��ѧ��ѧ�г����ĵ��ʻ������֮���ת����ϵ��ͼ��ʾ�����ֲ�������ȥ������W��X�������ǣ�������| ѡ�� | W | X |
| A | ϡ���� | NaAlO2��Һ |
| B | ϡ���� | Fe |
| C | CO2 | Ca��OH��2��Һ |
| D | Cl2 | Fe |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������������������������зֱ���ȫȼ�գ��ų�����һ���� | |
| B�� | ��Ҫ���Ȳ��ܷ����ķ�Ӧһ�������ȷ�Ӧ | |
| C�� | ��101kpaʱ��2gH2��ȫȼ�գ�����Һ̬ˮ���ų�285.8kJ������������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��2H2��g��+O2��g���T2H2O��l����H=-285.8kJ/mol | |
| D�� | ��ǿ��ǿ��ϡ��Һ�У�H+��aq��+OH-��aq��=H2O��l����H=-57.3kJ/mol��������1molNaOH����Һ�ͺ�0.5molH2SO4��Ũ�����ϣ��ų�����������57.3 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ǵ����Ⱥ����ѧ���������մɡ�ұ��������������� | |
| B�� | ��ѧ�о�����ҪĿ������ʶ���� | |
| C�� | ��ѧ��ѧ�������о���Ա�˽⼲���IJ��� | |
| D�� | �������ѧ�Ұ���٤���������ԭ��ѧ˵��Ϊ������ѧ�ķ�չ�춨�˻��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com