
(16分)实验室中以粗铜(含杂质)为原料,某种制备铜的氯化物的流程如下:
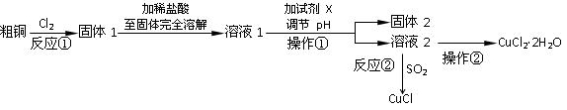
按要求回答下列问题:
(1)操作①的所用到的玻璃仪器有______________。
(2)上述流程中,所得固体1需要加稀盐酸溶解,其理由是 ;
溶液1可加试剂X用于调节pH以除去杂质, X可选用下列试剂中的(填序号)___________。
A.NaOH B.NH3·H2O C.CuO D.CuSO4
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出
制备CuCl的离子方程式: 。
(4)现用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)。
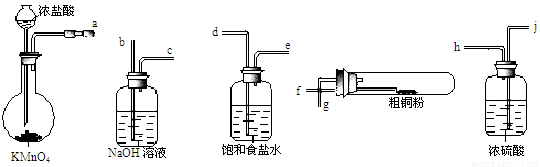
①按气流方向连接各仪器接口顺序是:a→ 、 → 、 → 、 → 。实验中大试管加热前要进行一步重要操作,其操作是 。
②反应时,盛粗铜粉的试管中的现象是 。
(5)在溶液2转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为绿色。小组同学欲探究其原因。已知:氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq) + 4Cl-(aq)  CuCl42-(aq) + 4 H2O (l)
CuCl42-(aq) + 4 H2O (l)
蓝色 绿色
该同学取氯化铜晶体配成蓝绿色溶液Y,进行如下实验,其中能证明溶液中有上述转化关系的是 (填序号)。
A.将Y稀释,发现溶液呈蓝色 B.在Y中加入CuCl2晶体,溶液变为绿色
C.在Y中加入NaCl固体,溶液变为绿色 D.取Y进行电解,溶液颜色最终消失
(1)漏斗、烧杯、玻璃棒;(2)抑制氯化铜、氯化铁水解;C D;
(3)SO2+2H2O+2Cu2++2Cl-=2CuCl+SO42-+4H+;
(4)①dehifgb;通入一段时间的氯气,将装置中的空气排尽;②产生大量棕黄色的烟;(5)ABC
【解析】
试题分析:(1)操作①是过滤。所用到的玻璃仪器有漏斗、烧杯、玻璃棒;(2)Cu与Cl2反应得到CuCl2,杂质也与氯气反应得到金属氯化物。CuCl2是强酸弱碱盐,容易水解,为了抑制氯化铜、氯化铁水解溶解固体在稀盐酸的环境中。溶液1的主要成分是CuCl2,若加试剂X用于调节pH以除去杂质, X应该是含有Cu2+的物质。选项为CD。(3)根据题意结合电子守恒、电荷守恒及原子守恒可得方程式:SO2+2H2O+2Cu2++2Cl-=2CuCl+SO42-+4H+;(4)①要经过制取气体、除去杂质、气体干燥、发生反应、尾气处理等实验步骤。按气流方向连接各仪器接口顺序是:a→d→e→h→i→f→g→b。实验中大试管加热前要进行一步重要操作,其操作是通入一段时间的氯气,将装置中的空气排尽再进行实验,否则Cu会被氧化为CuO;②在大试管发生反应:Cu+ Cl2 CuCl2,盛粗铜粉的试管中的现象是产生大量棕黄色的烟;(5)A.将Y稀释,即加入水,若存在上述平衡,则增大了水的浓度,平衡逆向移动,产生更多的蓝色的Cu(H2O)42+(aq)。正确。 B.在Y中加入CuCl2晶体,即增大了c(Cl-)的浓度,平衡正向移动,绿色的CuCl42-(aq)的浓度增大。溶液变为绿色。正确。C.在Y中加入NaCl固体,c(Cl-)的浓度增大,平衡正向移动,绿色的CuCl42-(aq)的浓度增大,溶液变为绿色。正确。D.取Y进行电解,溶液颜色最终消失,这与是哪种结合方式无关。错误。
CuCl2,盛粗铜粉的试管中的现象是产生大量棕黄色的烟;(5)A.将Y稀释,即加入水,若存在上述平衡,则增大了水的浓度,平衡逆向移动,产生更多的蓝色的Cu(H2O)42+(aq)。正确。 B.在Y中加入CuCl2晶体,即增大了c(Cl-)的浓度,平衡正向移动,绿色的CuCl42-(aq)的浓度增大。溶液变为绿色。正确。C.在Y中加入NaCl固体,c(Cl-)的浓度增大,平衡正向移动,绿色的CuCl42-(aq)的浓度增大,溶液变为绿色。正确。D.取Y进行电解,溶液颜色最终消失,这与是哪种结合方式无关。错误。
考点:考查混合物的分离、有气体参加的化学反应的所以步骤、盐的水解、离子方程式的书写等知识。


科目:高中化学 来源:2013-2014湖南省五市十校高一下学期期中教学质量检测化学试卷(解析版) 题型:选择题
X元素的阳离子与Y的阴离子具有相同的核外电子排布,则下列比较中正确的是
A.原子序数: X<Y B.原子半径:X<Y
C.离子半径:X>Y D.原子最外层电子数:X<Y
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省黄石市秋季高二化学期中统考试卷(解析版) 题型:选择题
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
有关该电池的说法正确的是( )
A.充电过程是化学能转化为电能的过程
B.充电时阳极反应:Ni(OH)2-e-+OH-=NiOOH+H2O
C.放电时负极附近溶液的碱性增强
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省黄石市秋季高二化学期中统考试卷(解析版) 题型:选择题
下列防腐措施中,利用原电池反应使主要金属得到保护的是( )
A.用氧化剂使金属表面生成致密稳定的氧化物保护膜
B.在金属中加入一些铬或镍制成合金
C.在轮船的壳体水线以下部分装上锌锭
D.金属表面喷漆
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高三5月模拟考试理综化学试卷(解析版) 题型:选择题
下列有关实验的叙述正确的是
A.已知Cu2O+2H+=Cu2++Cu+H2O,氢气还原氧化铜后生成的红色固体能完全溶于稀硝酸,说明还原产物是铜
B.在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的冷却温度作为末温度
C.仅用淀粉溶液、稀硫酸、碘水、新制氢氧化铜四种试剂可完成淀粉水解产物及水解程度检验的探究实验
D.向盛有少量Mg(OH )2悬浊液的试管中滴加氯化铵溶液,可以看到沉淀溶解
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高一下学期期中联考化学试卷(解析版) 题型:填空题
(11分)A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大;A有多种核素,其中一种没有中子;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不同的多种化合物。请回答下列问题:
(1) F在元素周期表中的位置是_______________;用电子式表示A与F两种元素组成的化合物的
形成过程______________________________________________。
已知下表中的数据是破坏1 mol物质中的化学键所吸收的能量(kJ),元素A的单质与元素F的单质在一定条件下反应生成2mol产物时释放的能量为____________kJ。
化学键 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
(2)用离子方程式表示E、F两种元素的非金属性强弱
还可以验证E、F两种元素非金属强弱的是(填写字母)
A.比较这两种元素的常见单质的沸点
B.比较这两种元素的单质与氢气化合的难易
C.比较这两种元素的最高价氧化物水化物的酸性
(3) A、C、E两两之间可形成甲、乙两种微粒,它们均为带一个单位负电荷的双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高一下学期期中联考化学试卷(解析版) 题型:选择题
化学与能源开发、环境保护、资源利用等密切相关。下列说法正确的是
A.天然气、石油、流水、风力、氢气为一级能源
B.无论是风力发电还是火力发电,都是将化学能转化为电能
C.PM 2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素
D.发展低碳经济、循环经济,推广利用太阳能、风能的城市照明系统
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省宜昌市高三5月模拟理综化学试卷(解析版) 题型:选择题
在2 L的密闭容器中发生反应xA(g)+yB(g) zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
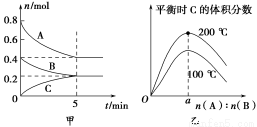
A.200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B.200℃时,该反应的平衡常数为25 L2/mol2
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g) zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com