
分析 (1)pH=6的蒸馏水中,离子积常数Kw=10-6×10-6=10-12,硫酸氢钠电离的氢离子抑制了水的电离,溶液中氢氧根离子是水电离的;
(2)根据溶度积常数确定先沉淀的物质,溶度积常数越小的物质越先沉淀,铜离子和氨水反应生成氢氧化铜和铵根离子;
(3)根据电荷守恒判断溶液酸碱性,电离平衡常数K=$\frac{c({H}^{+})c({A}^{-})}{c(HA)}$;
(4)根据氢氧化铁的溶度积常数计算溶液中氢氧根离子浓度,根据水的离子积常数计算氢离子浓度,从而得出溶液的pH.
解答 解:(1)pH=6的蒸馏水中,离子积常数Kw=10-6×10-6=10-12,保持温度不变,测得溶液的pH=1,则水电离出来的氢离子的浓度等于溶液中氢氧根的浓度,c(H+)=c(OH-)=$\frac{1{0}^{-12}}{0.1}$mol/L=1×10-11mol•L-1,
故答案为;1×10-11mol•L-1;
(2)溶度积常数越小的物质越先沉淀,氢氧化铜的溶度积小于氢氧化镁的溶度积,所以氢氧化铜先沉淀,铜离子和氨水反应生成氢氧化铜沉淀和铵根离子,离子方程式为Cu2++2NH3•H2O?Cu(OH)2↓+2NH4+,
故答案为:Cu(OH)2;Cu2++2NH3•H2O?Cu(OH)2↓+2NH4+;
(3)由溶液的电荷守恒可得:c(H+)+c(Na+)=c(A-)+c(OH-),已知c(Na+)=c(A-),则有c(H+)=c(OH-),所以溶液显中性;电离常数只与温度有关,
则此时HA的电离常数K=$\frac{c({H}^{+})c({A}^{-})}{c(HA)}$=$\frac{1{0}^{-7}×0.005}{\frac{a}{2}-0.005}$=$\frac{1{0}^{-9}}{a-0.01}$,
故答案为:中;$\frac{1{0}^{-9}}{a-0.01}$;
(4)当铁离子完全沉淀时,溶液中氢氧根离子浓度=$\root{3}{\frac{8×1{0}^{-38}}{1{0}^{-5}}}$mol/L=2×10-11mol/L,则溶液中氢离子浓度=$\frac{1{0}^{-14}}{2×1{0}^{-11}}$mol/L=5×10-4mol/L,则溶液的PH=-lg5×10-4-mol/L=3.3,
故答案为:3.3.
点评 本题考查了知识点较多,根据水的离子积常数、溶度积常数、电离平衡常数来分析解答即可,注意平衡常数只与温度有关,难度中等.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
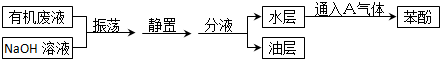
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究性学习小组进行原电池和电解的实验.
某研究性学习小组进行原电池和电解的实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有甲烷 | B. | 一定有乙烯 | C. | 可能有乙烷 | D. | 一定有丙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚烷(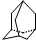 )分子中含有4个 )分子中含有4个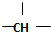 | |
| B. | 利用核磁共振氢谱可以鉴别乙醇和二甲醚 | |
| C. | 高聚物的相对分子质量不一定为单体相对分子质量的整数倍 | |
| D. | 苯、甲苯、乙苯、三硝基甲苯等都是芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素位于周期表的第二周期0族 | |
| B. | 该元素最高价氧化物对应水化物为强碱 | |
| C. | 该元素第一电离能为本周期最小 | |
| D. | 该元素电负性为短周期最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H8 和 C3H6 | B. | C2H6 和 C3H6 | C. | C2H4 和 C4H8 | D. | CH4 和 C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com