
| A.该溶液的pH=4 | B.升高温度,溶液的KW增大 |
| C.此酸的电离平衡常数约为1×10-7 | D.该溶液里不存在HA分子 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
 CH3COOH + OH—的平衡中,要使水解平衡向右移动,应采取的措施是
CH3COOH + OH—的平衡中,要使水解平衡向右移动,应采取的措施是
| A.加入NaOH固体 | B.加入冰醋酸 | C.增大压强 | D.升高温度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用HNO2溶液做导电实验,灯泡很暗; | B.0.1 mol/L HNO2溶液的pH=2.1 |
| C.HNO2不是离子化物,而是共价化合物 | D.HNO2和NaCl不能发生反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
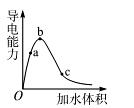
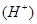 由小到大的顺序是 。
由小到大的顺序是 。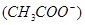 增大,c
增大,c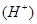 减少,可采取的措施是(至少写出三种方法)
减少,可采取的措施是(至少写出三种方法) 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 的醋酸溶液加水稀释时,下列说法正确的是( )
的醋酸溶液加水稀释时,下列说法正确的是( ) | A.溶液中氢氧根离子的浓度增大了 |
B.c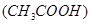 减小,电离平衡向生成醋酸分子的方向移动? 减小,电离平衡向生成醋酸分子的方向移动? |
| C.平衡向电离的方向移动,氢离子的浓度增大,醋酸分子的数量减少 |
D.电离程度增大,c 也增大了 也增大了 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Al2(SO4)3 ="=" 2Al+3 + 3SO4-2 | B.Na2CO3==Na2+ + CO32- |
| C.NaOH ="=" Na+ + OH- | D.NaHCO3 ==Na+ + H+ + CO32- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.V2=10V1 | B.V1<10 V2、 | C.10V1>V2 | D.V2>10V1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一定等于0.1mol?L-1 | B.一定大于0.1mol?L-1 |
| C.一定小于0.1mol?L-1 | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H++F-。25℃下,向20mL0.2mol?L-1的氢氟酸中滴加0.2mol?L-1的NaOH溶液时,溶液的pH变化如图所示。
H++F-。25℃下,向20mL0.2mol?L-1的氢氟酸中滴加0.2mol?L-1的NaOH溶液时,溶液的pH变化如图所示。
 )和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力,
)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力, 。
。 (HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是_______。
(HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是_______。 约为___ _%。
约为___ _%。 H+(aq)+F-(aq) △H=+b kJ?mol -1
H+(aq)+F-(aq) △H=+b kJ?mol -1 = Ka(HF)
= Ka(HF)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com