
异秦皮啶具有镇静安神抗肿瘤功效,秦皮素具有抗痢疾杆菌功效。它们在一定条件下可发生转化,如图所示。有关说法正确的是( )
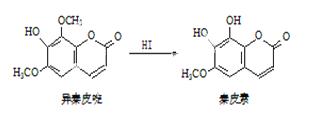
A.异秦皮啶与秦皮素互为同系物
B.异秦皮啶分子式为C11H12O5
C.秦皮素一定条件下能发生加成反应、消去反应和取代反应
D.1mol秦皮素最多可与2molBr2(浓溴水中的)、4molNaOH反应
【知识点】有机物的结构与性质
【答案解析】D 解析:A、异秦皮啶与秦皮素结构不相似,不能互为同系物,故A错误;B、异秦皮啶分子式为C11H10O5,故B错误;C、秦皮素结构中含有碳碳双键、酯基、酚羟基,一定条件下能发生加成反应和取代反应,不能发生消去反应,故C正确;D、1mol秦皮素酚羟基的对位可以与1molBr2发生取代,碳碳双键可以与1molBr2发生加成反应,最多可与2molBr2反应;酯基水解产物有酚羟基和羧基,一共有3个酚羟基和一个羧基,可与4molNaOH反应,故D正确;
故答案选D
【思路点拨】本题考查有机物的官能团和基本性质,C选项中酯基水解产物有酚,还能与氢氧化钠继续反应,为易错点。


科目:高中化学 来源: 题型:
如图所示,下列说法不正确的是( )。
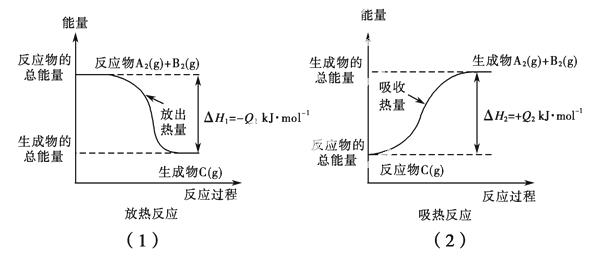
A.反应过程(1)的热化学方程式为A2(g)+B2(g)===C(g) ΔH1=-Q1kJ·mol-1
B.反应过程(2)的热化学方程式为C(g)===A2(g)+B2(g) ΔH2=+Q2 kJ·mol-1
C.Q1与Q2的关系:Q1>Q2
D.ΔH2>ΔH1
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W代表短周期的四种元素,有关它们的部分结构及性质信息如下表所示。
| 元素 | 部分结构信息 | 部分性质信息 |
| X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
请按要求回答下列问题(注意不能用字母X、Y、Z、W作答):
(1)X的气态氢化物分子的电子式是________________________,Z元素在周期表中的位置是________。
(2)X、Y、Z三元素的最高价氧化物对应水化物的酸性由强到弱的顺序是__________________________________________________。
(3)常温时,W的硫酸盐溶液的pH________7(填“<”、“>”或“=”),理由是__________________________________________________________
_____________________________________________ (用离子方程式表示)。
(4)实验室用X的氢化物的水溶液制取W的氢氧化物的方法是(用离子方程式表示)______________________________________________。
(5)25 ℃、101 kPa时,32 g Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1 780.6 kJ的热量,写出该反应的热化学方程式:_______
______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作不能达到预期目的的是 ( )
| 实验目的 | 操作 | |
| A | 欲比较水和乙醇中羟基氢的活泼性 | 用金属钠分别与水和乙醇反应 |
| B | 欲证明CH2=CHCHO中含有碳碳双键 | 滴加酸性KMnO4溶液,看紫红色是否褪去 |
| C | 欲确定磷、砷两元素非金属性的强弱 | 测定同温同浓度的Na3PO4和Na3AsO4水溶液的pH |
| D | 欲除去苯中混有的苯酚 | 向混合液中加入NaOH溶液,充分反应后,分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某烷烃相对分子质量为86,如果分子中含有3个—CH3、
2个—CH2—和1个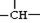 ,则该结构的烃的一氯取代物最多可能有( )种(不考虑立体异构)
,则该结构的烃的一氯取代物最多可能有( )种(不考虑立体异构)
A.4 B.5 C.6 D.9
查看答案和解析>>
科目:高中化学 来源: 题型:
液晶高分子材料应用广泛,新型液晶基元﹣﹣化合物IV的合成线路如下:
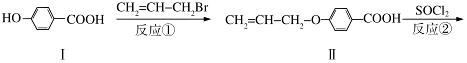
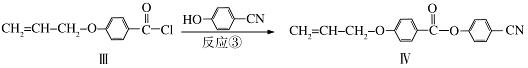
(1)化合物Ⅰ的分子式为 ,1mol化合物Ⅰ最多可与 mol NaOH反应。
(2)CH2=CH﹣CH2Br与NaOH水溶液反应的化学方程式为 (注明条件)。
(3)化合物I的同分异构体中,苯环上一溴代物只有2种且能发生银镜反应的化合物有多种,写出其中一种同分异构体的结构简式 (任写一种)。
(4)反应③的反应类型是 .在一定条件下,化合物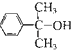 也可与III发生类似反应③的反应生成有机物V,V的结构简式是 。
也可与III发生类似反应③的反应生成有机物V,V的结构简式是 。
(5)下列关于化合物Ⅳ的说法正确的是 (填字母)。
A.属于烯烃 B.能与FeCl3溶液反应显紫色
C.一定条件下能发生加聚反应 D.能使溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
工业废水中常含有一定量的Cr2O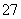 ,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一。该法用Fe作电极电解含Cr2O
,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一。该法用Fe作电极电解含Cr2O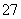 的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的。下列有关说法不正确的是( )
的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的。下列有关说法不正确的是( )
A.电解时选用Fe作阳极,石墨棒作阴极
B.阴极附近的沉淀只有Cr(OH)3
C.阳极附近溶液中,发生反应的离子方程式是Cr2O +6Fe2++14H+===2Cr3++6Fe3++7H2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O
D.消耗1 mol Cr2O ,将有336 g Fe消耗,因此要定期更换铁电极
,将有336 g Fe消耗,因此要定期更换铁电极
查看答案和解析>>
科目:高中化学 来源: 题型:
用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1 mol/L FeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压值):
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(1)用KSCN溶液检验出Fe3+的现象是________。
(2)Ⅰ中,Fe3+产生的原因还可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应的离子方程式:________________________________________________。
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电。原因是Fe2+具有________性。
(4) Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:
Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
①NaCl溶液的浓度是________mol/L。
②Ⅳ中检验Cl2的实验方法:_____________________________________________________。
③与Ⅱ对比,得出的结论(写出两点):_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com