
在一定温度下,固定体积为2L密闭容器中,发生反应:2SO2(g)+O2(g)  2SO3(g) △H<0,n(SO2)随时间的变化如表:
2SO3(g) △H<0,n(SO2)随时间的变化如表:
时间/min | 0 | 1 | 2 | 3 | 4 | 3 |
n(SO2)/mol | 0.20 | 0.1 6 | 0.13 | 0.11 | 0.08 | 0.08 |
则下列说法正确的是
A.当v(SO2)=v(SO3)时,说明该反应已达到平衡状态
B.用O2表示0~4min内该反应的平均速率为0.005mol/(L·min)
C.若升高温度,则SO2的反应速率会变大,平衡常数K值会增大
D.平衡时再通入O2,平衡右移,O2转化率减小,SO2转化率增大
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
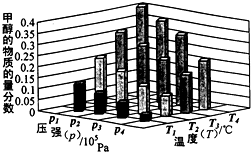 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
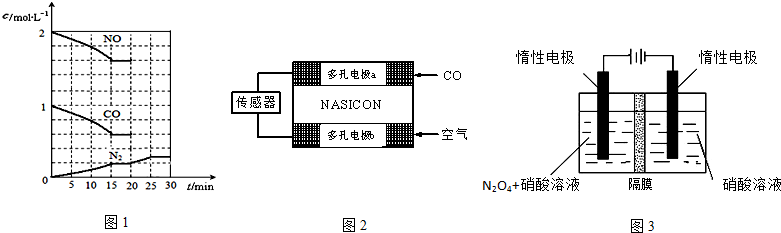
查看答案和解析>>
科目:高中化学 来源: 题型:
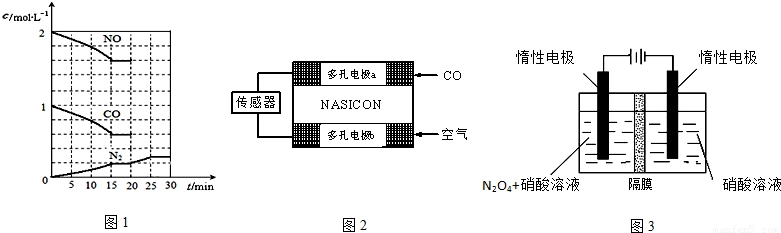
已知A、B、C、D、E、F、G七种物质有如下转化关系。A、B、C、E都是由两种元素组成的化合物,D、F、G在常温下分别是固态、液态、气态单质,D、F的组成元素在周期表中位于同一主族。E溶液为浅绿色,与NaOH溶液反应生成的白色沉淀极易被氧化。

试回答下列问题:
(1)写出A与B反应的化学方程式 。
(2)写出E溶液与F单质反应的离子方程式 。
(3)检验A中阳离子最常用的试剂可用一种钾盐,其化学式为 。
(4)实验室制得的B所体,不能用浓硫酸作干燥剂,其原因是 。
(5)用惰性电极电解C溶液,其阳极反应为 ,当转移1mole时在阴极可收集到气体的体积为 L(标准状况下)
(6)将2mol 气体B放入某固定容积的密闭容器中,在一定温度下反应达到平衡,测得D蒸气的体积分数为40%。若其它条件不就,再向该容器中充入2mol气体B,当体系的颜色不再变化时D蒸气的体积分数 (填“大于”、“小于”、“等于”)40%。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省四校高二(上)期末化学试卷(仙桃中学、麻城一中、新洲一中、武汉二中)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com