
【题目】某气态烃A,标准状况下的密度为1.25g/L,B和D都是生活中常见的有机物,D能跟碳酸氢钠反应,E有香味。它们之间的转化关系如下图所示:
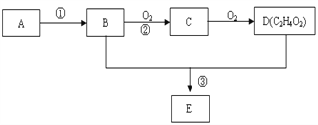
(1)A的电子式为______________,D中官能团的名称为__________。
(2)以A为原料自身合成高分子化合物的化学方程式为________________。
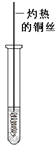
(3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中(如右图所示),重复操作2-3次,观察到的现象是铜丝由黑色变红色。 写出过程②反应方程式 _____________。
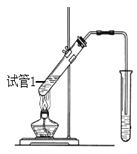
(4)B、D在浓硫酸的作用下实现反应③,实验装置如下图所示:
①试管1中实现反应③的化学方程式为_________________________________。
②反应开始时用酒精灯对试管小火加热的原因是:_______________________________。(已知乙酸乙酯的沸点为77℃;乙醇的沸点为78.5℃;乙酸的沸点为117.9℃)
【答案】 ![]() 羧基 nCH2 = CH2
羧基 nCH2 = CH2![]()
![]() CH2-CH2
CH2-CH2![]() 2CH3CH2OH+O2
2CH3CH2OH+O2![]() 2CH3CHO + 2H2O CH3COOH+CH3CH2OH
2CH3CHO + 2H2O CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 防止由于温度过高使反应物来不及充分反应而被蒸出
CH3COOCH2CH3+H2O 防止由于温度过高使反应物来不及充分反应而被蒸出
【解析】已知气态烃A在标准状况下的密度为1.25g/L,则M(A)= 1.25g/L×22.4L/mol=28g/mol,D的分子式为C2H4O2,且能与碳酸氢钠反应,则D为乙酸,由此推知A为乙烯,B为乙醇,C为乙醛,E为乙酸乙酯。则
(1)A为乙烯,其电子式为![]() ,D中官能团的名称为羧基。
,D中官能团的名称为羧基。
(2)乙烯可通过自身加聚反应合成高分子化合物聚乙烯,化学方程式为nCH2 = CH2![]()
![]() CH2-CH2
CH2-CH2![]() 。
。
(3)在铜作催化剂的条件下,乙醇可氧化为乙醛,反应的方程式为2CH3CH2OH+O2![]() 2CH3CHO + 2H2O(或者写成两个:2Cu+O2
2CH3CHO + 2H2O(或者写成两个:2Cu+O2![]() 2CuO,CH3CH2OH+CuO
2CuO,CH3CH2OH+CuO![]() CH3CHO+Cu+H2O。
CH3CHO+Cu+H2O。
(4)在浓硫酸作用下,乙醇和乙酸反应生成乙酸乙酯,所以反应③的化学方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;由于乙酸、乙醇以及乙酸乙酯都是易挥发性物质,为了防止反应物大量蒸发,使其充分反应,提高转化率,实验开始时要小火加热试管。
CH3COOCH2CH3+H2O;由于乙酸、乙醇以及乙酸乙酯都是易挥发性物质,为了防止反应物大量蒸发,使其充分反应,提高转化率,实验开始时要小火加热试管。


科目:高中化学 来源: 题型:
【题目】电解Na2CO3溶液制取NaHCO3溶液和NaOH溶液的装置如下图所示。下列说法中,不正确的是

A. 阴极产生的物质A是H2
B. 溶液中Na+由阳极室向阴极室迁移
C. 阳极OH﹣放电,H+浓度增大,CO32-转化为HCO3-
D. 物质B是NaCl,其作用是增强溶液导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设想合成具有以下结构的四种烃分子,下列有关说法错误的是

A. 1mol甲分子内含有10mol共价键 B. 乙分子的一氯取代产物只有一种
C. 丙分子的二氯取代产物只有两种 D. 丁分子显然是不可能合成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是
A. 已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol,则氢气的燃烧热为241.8 kJ/mol
B. 已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定
C. 已知2C(s)+2O2(g)=2CO2(g) △H1; 2C(s)+O2(g)=2CO(g) △H2;,则△H1>△H2
D. 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则该反应中和热的热方程式为NaOH(aq)+ HCl(aq)=NaCl(aq)+H2O(l) △H=一57.4kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。在下列三种晶体①金刚石 ②晶体硅 ③碳化硅中它们的熔点,从高到低的顺序是( )
A. ①③② B. ②③① C. ③①② D. ②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明的酸性溶液中,能大量共存的离子组为
A.Na+、K+、SO42-、HS-B.Na+、K+、SiO32-、NO3-
C.Na+、K+、Cl-、SO42-D.Fe3+、NO3-、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①白磷 ②金刚石 ③石墨 ④二氧化硅⑤甲烷 ⑥四氯化碳 ⑦铵根离子,其分子结构或晶体结构单元中存在正四面体的是( )
A. ①②④⑤⑥⑦ B. ①②⑤⑥ C. ②⑦ D. ③④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究Na2S溶液与KMnO4溶液反应,探究过程如下。
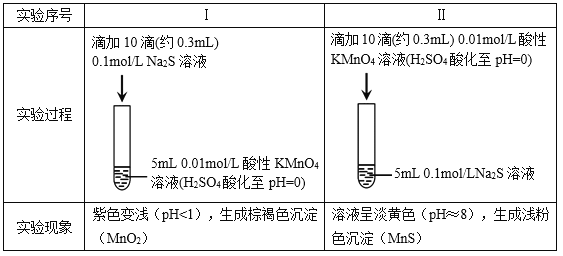
资料:ⅰ. ![]() 在强酸性条件下被还原为Mn2+,在近中性条件下被还原为MnO2。
在强酸性条件下被还原为Mn2+,在近中性条件下被还原为MnO2。
ⅱ. 单质硫可溶于硫化钠溶液,溶液呈淡黄色。
(1)根据实验可知,Na2S具有________性。
(2)甲同学预测实验I中S2–被氧化成![]() 。
。
①根据实验现象,乙同学认为甲的预测不合理,理由是________。
②乙同学取实验I中少量溶液进行实验,检测到有![]() ,得出S2–被氧化成
,得出S2–被氧化成![]() 的结论,丙同学否定了该结论,理由是________。
的结论,丙同学否定了该结论,理由是________。
③同学们经讨论后,设计了如下实验,证实该条件下![]() 的确可以将S2–氧化成
的确可以将S2–氧化成![]() 。
。
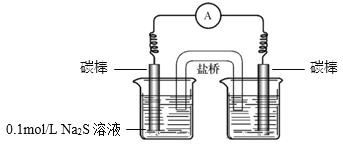
a.右侧烧杯中的溶液是________。
b.连通后电流计指针偏转,一段时间后,________(填操作和现象)。
(3)实验I的现象与资料i存在差异,其原因是新生成的产物(Mn2+)与过量的反应物(![]() )发生反应,该反应的离子方程式是________。
)发生反应,该反应的离子方程式是________。
(4)实验II的现象与资料也不完全相符,丁同学猜想其原因与(3)相似,经验证猜想成立,他的实验方案是______。
(5)反思该实验,反应物相同,而现象不同,体现了物质变化不仅与其自身的性质有关,还与________因素有关。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com