
目前半导体生产展开了一场“铜芯片”革命——在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:
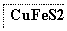
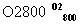
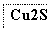
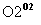
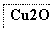
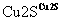
 ―→
―→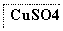
(1)基态铜原子的外围电子排布式为__________________,硫、氧元素相比,第一电离能较大的元素是________(填元素符号)。
 (2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是________,其立体结构是______________。
(2)反应①、②中均生成有相同的气体分子,该分子的中心原子杂化类型是________,其立体结构是______________。
(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液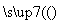 蓝色沉淀
蓝色沉淀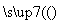 沉淀溶解,得
沉淀溶解,得
到深蓝色透明溶液。写出蓝色沉淀溶于氨水的离
子方程式_______________________;深蓝色透明
溶液中的阳离子(不考虑H+)内存在的全部化学
键类型有 。
(4) 铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途,铜晶体中铜原子堆积模型为_____________;铜的某种氧化物晶胞结构如图所示,若该晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞中铜原子与氧原子之间的距离为________pm。((用含d和NA的式子表示)。
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
下列物质的名称、俗名与化学式完全对应的是
A.氯化钠 食盐 NaCl2 B.碳酸氢钠 纯碱 NaHCO3
C.氢氧化钙 熟石灰 CaO D.氢氧化钠 烧碱 NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
活性氧化锌在橡胶、化工、涂料、陶瓷、医药、电子等行业有着广泛的应用,下图是以含锌铜烟尘(火法炼铜的副产品,主要成分是ZnO、CuO和FeO)制备活性氧化锌的工艺流程:
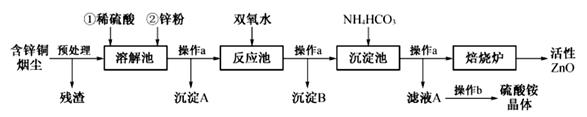
已知:①含锌铜烟尘经过预处理后的主要成分是ZnO,还含有少量的CuO和Fe2O3
②反应池中的温度控制在90~95℃,反应池中所发生反应的离子方程式为
2Fe2++H2O2+4H2O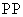 2Fe(OH)3↓+4H+
2Fe(OH)3↓+4H+
试回答下列问题:
(1)在实验室中,进行操作a用到的主要玻璃仪器有:烧杯、 、 。
(2)溶解池中待固体全部溶解后,加入锌粉的作用有:
①将Fe3+还原为Fe2+;
② ;
③调节溶液的pH。
(3)检验溶解池中Fe2+已全部被还原为Fe2+的实验方法是 。
(4)沉淀池中得到的沉淀化学式可以表示为aZnCO3·bZn(OH)2·cH2O(a、b、c均为整数)。
某校化学兴趣小组的同学为了确定其组成,进行如下实验:称取3.59g沉淀进行焙烧,
将焙烧过程中产生的气体依次通过足量的浓硫酸和碱石灰,它们分别增重0.72g和0.44g,
通过计算确定该沉淀的组成。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
往2L密闭容器中充入NO2,在三种不同条件下发生反应: ,实验测得NO2的浓度随时间的变化如下表(不考虑生成N2O4)
,实验测得NO2的浓度随时间的变化如下表(不考虑生成N2O4)

下列说法正确的是
A.实验2比实验1的反应容器内压强减小
B.实验2比实验l使用了效率更高的催化剂
C.实验1比实验3的平衡常数大
D.实验2和实验3可判断该反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中书写正确的是( )
A.铁和稀硫酸反应: 2Fe+6H+===2Fe3++3H2↑
B.碳酸钙和稀盐酸反应: CaCO3+2H+===Ca2++CO2↑+H2O
C.将Cl2通入KI溶液中: I-+Cl2===Cl-+I2
D.硫酸镁溶液与氢氧化钡溶液反应: Mg2++2OH-===Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的分类或归类不正确的是( )
①混合物:碘酒、盐酸、牛奶、水银 ②化合物:CaCl2、烧碱、硫酸铜晶体、HD
③电解质:明矾、醋酸、硫酸钡 ④纯净物:干冰、冰水混合物、浓硫酸
⑤同位素: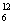 C、
C、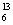 C、
C、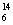 C
C
A.①②③④ B.①②④ C.①③④⑤ D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe2++H2O2+2H+===2Fe3++2H2O
2Fe3++H2O2===2Fe2++O2↑+2H+
下列说法不正确的是( )
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
B.在反应过程中,溶液的pH不变
C.在反应过程中,Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com