
【题目】某研究性学习小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(ClO)2+ CaCl2+ 2H2SO4 ![]() 2CaSO4 + 2Cl2↑+ 2H2O,他们设计如下实验用于制取氯气并验证其性质。
2CaSO4 + 2Cl2↑+ 2H2O,他们设计如下实验用于制取氯气并验证其性质。

试回答:
(1)该实验中A部分的装置是________(填写装置的序号)。
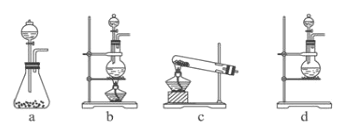
(2)B中的实验现象为___________________________ 。
(3)用离子方程式表示C中亚硫酸钠被氧化的主要原因,_____________________。请你帮助他们设计一个实验,证明洗气瓶C中的亚硫酸钠已被氧化(简述实验步骤)_____________。
(4)请根据题意画出D处的实验装置图,并注明盛放的物质______。
【答案】b 溶液由无色变为黄色或棕褐色(或变成黄色后褪色,有学生想到氯气会继续和碘反应) SO32- + Cl2 + H2O = SO42- + 2Cl- + 2H+ 从C中取出少量溶液至小试管中,加入足量的稀盐酸,然后滴加BaCl2溶液,若产生白色沉淀,则证明亚硫酸钠已被氧化 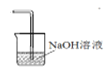
【解析】
化学方程式为Ca(ClO)2+CaCl2+H2SO4![]() 2CaSO4+2Cl2↑+2H2O,应在加热的条件下反应,氯气具有强氧化性,可与KI反应生成I2,可将亚硫酸钠氧化成硫酸钠,氯气有毒,不能排放到空气中,由于可与碱反应,则可用NaOH溶液进行尾气的吸收,以此解答该题。
2CaSO4+2Cl2↑+2H2O,应在加热的条件下反应,氯气具有强氧化性,可与KI反应生成I2,可将亚硫酸钠氧化成硫酸钠,氯气有毒,不能排放到空气中,由于可与碱反应,则可用NaOH溶液进行尾气的吸收,以此解答该题。
(1)由方程式可知反应为固体和液体的反应,应在加热的条件下反应,应用装置b进行制备,故答案为:b;
(2)装置B中发生反应的离子方程式为Cl2+2I-=I2+2Cl-,实验现象为溶液由无色变为黄色或棕褐色(或变成黄色后褪色,过量的氯气会继续和碘反应生成HCl和HIO3);
(3)C中亚硫酸钠被氯气氧化生成硫酸钠,反应的离子方程式为SO32- + Cl2 + H2O = SO42- + 2Cl- + 2H+;设计实验证明洗气瓶C中的亚硫酸钠已被氧化,即证明有硫酸钠生成,实验操作为从C中取出少量溶液至小试管中,加入足量的稀盐酸,然后滴加BaCl2溶液,若产生白色沉淀,则证明亚硫酸钠已被氧化;
(4)氯气有毒,不能排放到空气中,由于可与碱反应,则可用NaOH溶液进行尾气的吸收,D处的实验装置图可为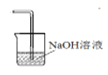 。
。


 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】将18g甲烷与乙烯的混合气通入盛有足量溴水的洗气瓶,反应后溴水增重14g,则混合气体中甲烷和乙烯的体积比是
A. 2:1 B. 1:2 C. 3:2 D. 2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种物质在一定条件下具有如图所示的转化关系,下列判断正确的是
![]()
A. 若图中反应均为非氧化还原反应,当W为一元强碱时,则X可能是NaAlO2
B. 若图中反应均为非氧化还原反应,当W为一元强酸时,则X可能是NH3
C. 若图中反应均为氧化还原反应,当W为非金属单质时,则Z可能是CO2
D. 若图中反应均为氧化还原反应,当W为金属单质时,则Z可能是FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年1月9日,中国中医科学院青嵩家专家屠呦呦研究员获得2016年度国家科学技术奖最高奖。青蒿素为烃的含氧衍生物,无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。某学习小组模拟从青嵩中提取青嵩素,并设计实验测定青嵩素的分子结构。
(1)青嵩素的提取
从青嵩中提取青蒿素的方法主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:

已知:乙醚沸点为35℃。
①操作I的名称为______。
②操作III的主要过程可能是_____________。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(2)青蒿素分子式的测定
可用燃烧法测定青蒿素的实验式,所需装置如下:
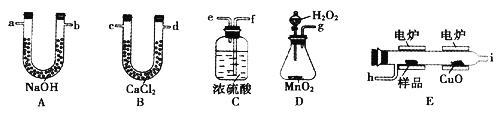
①产生的氧气按以左到右流向,所选装置各导管的连接顺序是g→c→_______→盛有碱石灰的干燥管(装置不能重复使用)。
②B装置的作用是______。
③E装置中CuO的作用是_______。
④称取28.2g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A装置质量增加66g,C装置质量增加19.8g,则该有机物的最简式为_______。
⑤若把盛有碱石灰的干燥管的装置去掉,所测得样品中氧的质量分数会_____(填“偏大”。“偏小”或“不变”)。
⑥要确定该有机物的分子式,还需要调定的物理量为_______。
⑦将青蒿素加入滴有酚酞NaOH溶液中,溶被颜色无明显变化,加热并搅拌,溶液红色变浅,说明青蒿素可能与_____(填字母)具有相同的性质。
A.乙醇 B.苯酚 C.丙酸 D.油脂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质均为Wg,将它们在氧气中完全燃烧的产物全部通入到过量的过氧化钠固体中,则过氧化钠固体增重为大于Wg的是()
①CH3CH2OH②HOOCCOOH③CH4④HCHO⑤CH3COOH⑥HCOOH
A. ④⑤ B. ②⑥ C. ①③ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四只盛有不同溶液的烧杯中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图(忽略CO2的溶解和HCl的挥发):

则下列分析都正确的组合是( )
①I图对应溶液中的溶质为NaHCO3
②II图对应溶液中的溶质为Na2CO3和NaHCO3,且二者的物质的量之比为1:1
③III图对应溶液中的溶质为NaOH和Na2CO3,且二者的物质的量之比为1:1
④IV图对应溶液中的溶质为Na2CO3
A.①② B.①③ C.②④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示实验装置,烧瓶内充满氯气,底部有一层细沙(不参与反应),玻璃导管下口b处塞有一小块钠。从a口伸入一根细铁丝把钠块捅下去,再用滴管从a口滴下一滴水,恰好落在钠块上,立即剧烈反应。下列对此实验的说法中,不正确的是()

A. 所充氯气应用向上排空气法收集
B. 反应中,烧瓶内产生大量白色烟雾
C. 玻璃导管只起到定位加入钠和水的作用
D. 烧瓶中Cl2,可能参与四个氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(选修5——有机化学基础)
呋喃(C4H4O)是生产抗流感药物磷酸奥司他韦(又名达菲)的原料之一,以玉米芯为原料制备呋喃及相关衍生物的一种工艺流程如下:
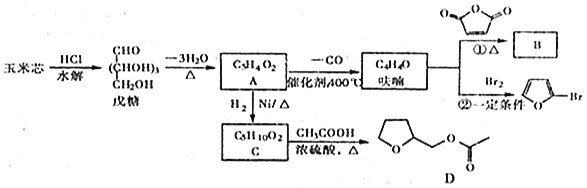
已知:ⅰ)A可以发生银镜反应
ⅱ)![]()
(1)D的分子式为___________________。
(2)呋喃的结构简式为___________;②的反应类型为________________。
(3)A发生银镜反应的化学方程式 ____________________________________________。
(4)C生成D的化学方程式__________________________________________。
(5)反应①在有机合成中具有重要意义,则B的结构简式为__________ 。
(6)C的同分异构体中,含有“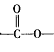 ”结构的共有____________ 种(不含立体导构),其中能发生很镜反应,且核磁共振氢谱中有2组吸收峰的有机物的结构简式为________ 。
”结构的共有____________ 种(不含立体导构),其中能发生很镜反应,且核磁共振氢谱中有2组吸收峰的有机物的结构简式为________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[选修3:物质结构与性质]东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为______3d能级上的未成对电子数为_______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
氨的沸点______(填“高于”或“低于”)膦(PH3),原因是_________________
氨是______分子(填“极性”或“非极性”),中心原子的轨道杂化类型为______。
(3)单质铜及镍都是由______键形成的晶体;元素铜与镍的第二电离能分别为ICu=1 958 kJ·mol–1、INi=1 753 kJ·mol-1,ICu>INi的原因是_______________________________。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com