
| A、得到氧元素与失去氧元素 |
| B、有无新物质生成 |
| C、化合价的升降 |
| D、电子的得失或共用电子对的偏移 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
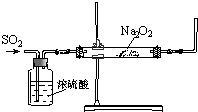 同学们利用如图装置探究SO2与Na2O2的反应.
同学们利用如图装置探究SO2与Na2O2的反应.| 实验步骤编号 | 实验操作 | 预期现象和结论 |
| ① | / | |
| ② | 向①的试管中加入 | |
| ③ | ||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2(g)的燃烧热为571.6 kJ?mol-1 | ||||||
| B、同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 | ||||||
C、
| ||||||
| D、3H2(g)+CO2(g)=CH3OH(l)+H2O(l)△H=+135.9 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用托盘天平称取8gNaOH固体(NaOH固体放置于天平的托盘上),放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解 |
| B、称取8gNaOH固体,放入100mL量筒中,边搅拌边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL |
| C、称取8gNaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 |
| D、用50mL量筒量取40mL5mol/LNaOH溶液,倒入100mL容量瓶中,然后加蒸馏水定容直至刻度线,盖好瓶塞,反复摇匀,装瓶就行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、亚硝酸盐是还原剂 |
| B、维生素C发生还原反应 |
| C、维C将Fe3+转化成Fe2+ |
| D、亚硝酸盐被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称取7.68 g硫酸铜,加入500 mL水 |
| B、称取12.5 g胆矾配成500 mL溶液 |
| C、称取8.0 g硫酸铜,加入500 mL水 |
| D、称取12.0 g胆矾配成500 mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
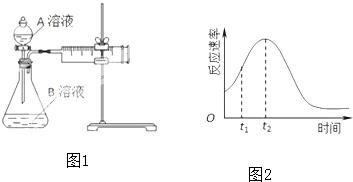
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol?L-1H2C2O4溶液 | 30mL 0.01mol?L-1KMnO4溶液 |
| ② | 20mL 0.2mol?L-1H2C2O4溶液 | 30mL 0.01mol?L-1KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、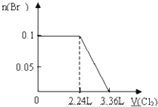 |
B、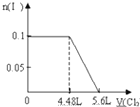 |
C、 |
D、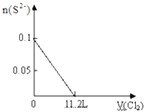 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com