
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )| 选项 | W | X |
| A | 盐酸 | Na2CO3溶液 |
| B | Cl2 | Fe |
| C | CO2 | Ca(OH)2溶液 |
| D | NaOH溶液 | AlCl3溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | 乙炔 | 氧气 | 水 | 二氧化碳 | M |
| 反应前质量/g | 5.2 | 14.4 | 0.4 | 0 | 0 |
| 反应后质量/g | 0 | 0 | 4.0 | m | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
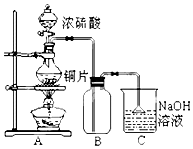 某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)| 序号 | 不合理的原因 | 误差 (偏低或偏高) | 改变措施 |
| 方案① | |||
| 方案② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 | |
| B. | AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 | |
| C. | pH=4的CH3COOH与CH3COONa混合溶液中,c(Na+)<c(CH3COO-) | |
| D. | 将pH=6的H2SO4稀释1000倍后,c(H+)=2 c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氯气通入足量氢氧化钠溶液中,当消耗4nmolNaOH时,反应中转移的电子为4nN0 | |
| B. | 4.4g由N2O和CO2组成的混合气体含0.3N0个原子 | |
| C. | 23.4gNaCl晶体中含0.1N0个如图所示的结构单元 | |
| D. | 7.8gNa2O2与足量潮湿的CO2反应,转移的电子数为0.1N0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①② | C. | ②③ | D. | ①③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com