
分析 等质量的CO和SO2两种气体的物质的量之比与摩尔质量成反比.根据N=nA计算分子数目之比,结合分子式计算氧原子数目之比,根据$ρ=\frac{m}{V}$,压强之比等于物质的量之比,由此分析解答.
解答 解:质量的CO和SO2两种气体的物质的量之比与摩尔质量成反比,所以两者的物质的量之比为:64:28=16:7,所以分数之比为:16:7;所含氧原子之比16:7×2=8:7;根据$ρ=\frac{m}{V}$,质量和体积相同,所以密度之比为:1:1,压强之比等于物质的量之比,即之比为:16:7,故答案为:16:7; 8:7; 16:7.
点评 本题考查物质的量有关计算,注意对公式的理解与灵活应用,可以利用阿伏伽德罗定律及其推论判断同温同压下气体分子数目之比等于气体体积之比.


科目:高中化学 来源: 题型:选择题
| A. | 正极为 Cu,负极为 Fe,电解质为 FeCl3 溶液 | |
| B. | 正极为Fe,负极为Zn,电解质为 Fe(NO3)3 溶液 | |
| C. | 正极为 Fe,负极为 Zn,电解质为 FeSO4 溶液 | |
| D. | 正极为 Ag,负极为 Fe,电解质为 CuSO4 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2 与过量乙烷在光照下反应,生成的有机物中含有氯原子的总数为2NA | |
| B. | 1molC3H8 中含有的共用电子对数为11NA | |
| C. | 1.5g 甲基含有的质子数和电子数之和为1.8NA | |
| D. | 标况下,11.2 L癸烷含有的原子个数为16 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮是重要的非金属元素,其单质用途之一是制取氨气,反应方程式为:N2(g)+3H2(g)?2NH3(g):回答下列问题:
氮是重要的非金属元素,其单质用途之一是制取氨气,反应方程式为:N2(g)+3H2(g)?2NH3(g):回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
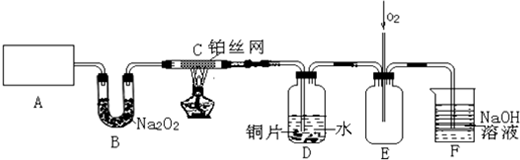
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
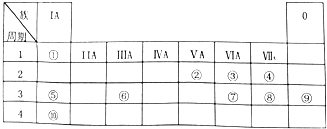
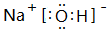 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com