
【题目】从生活常识角度考虑,试推断钠元素在自然界中存在的主要形式是 ( )
A. NaB. NaClC. NaOHD. Na2O
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁.实验室制备装置和工业制备流程图如图: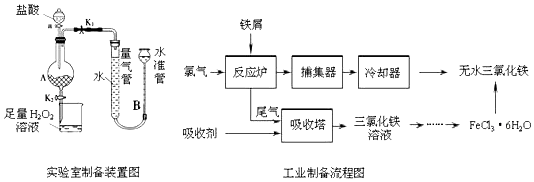
已知:①无水FeCl3的熔点为555K、沸点为588K.
②废铁屑中的杂质不与盐酸反应
③不同温度下六水合氯化铁在水中的溶解度如表:
温度/℃ | 0 | 20 | 80 | 100 |
溶解度(g/100 g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
Ⅰ打开弹簧夹K1 , 关闭弹簧夹K2 , 并打开活塞a,缓慢滴加盐酸.
Ⅱ当装置A中不产生气泡或量气管和水准管液面不变时,关闭弹簧夹K1 , 打开弹簧夹K2 , 当A中溶液完全进入烧杯后关闭活塞a.
Ⅲ将烧杯中溶液经过一系列操作后得到FeCl36H2O晶体.
(1)烧杯中足量的H2O2溶液的作用是 .
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“…”的内容是 .
(3)从FeCl3溶液制得FeCl36H2O晶体的操作步骤是:加入后、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)试写出吸收塔中反应的离子方程式: .
(5)捕集器温度超过673K时,存在相对分子质量为325的铁的氯化物,该物质的分子式为
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100mL溶液;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c molL﹣1 Na2S2O3溶液滴定,消耗V mL(已知:I2+2S2O32﹣═2I﹣+S4O62﹣).
①滴定过程中可能造成实验结果偏低的是
A.锥形瓶未润洗 B.锥形瓶中溶液变色后立刻停止滴定,进行读数
C.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡 D.滴定终点时仰视读数
②样品中氯化铁的质量分数.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:3CH4(g)+2N2(g)3C(s)+4NH3(g)△H>0,700℃时,CH4与N2在不同物质的量之比[ ![]() ]时CH4的平衡转化率如图所示.下列说法正确的是( )
]时CH4的平衡转化率如图所示.下列说法正确的是( ) 
A.![]() 越大,CH4的转化率越高
越大,CH4的转化率越高
B.![]() 不变时,若升温,NH3的体积分数会增大
不变时,若升温,NH3的体积分数会增大
C.b点对应的平衡常数比a点的大
D.a点对应的NH3的体积分数约为26%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应在一定条件下达到化学反应限度时
A. 反应停止了B. 正反应速率与逆反应速率均为零
C. 反应物全部转化成生成物D. 反应物和生成物浓度不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在新制氯水中加入紫色石蕊试液的现象是________________,说明氯水中含有(填化学式或离子符号)____________;向氯水中加入NaHCO3溶液发生反应的离子方程式为______________________。
(2)制取漂白粉的化学反应方程式为______________________________________,反应中氧化剂与还原剂的质量比为_________,漂白粉的有效成分是________,它在空气中变质的原因是(用化学方程式表示)_______________________,______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于图中各装置的叙述不正确的是( ) 
A.装置①中X若为四氯化碳,可用于吸收氨气,并防止倒吸
B.装置②可检验溴乙烷发生消去反应得到的气体中含有乙烯
C.装置③的两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不相同
D.装置④能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g)═CH3OCH3(g)+H2O(g),下列说法正确的是( )
容器 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
A.该反应的正方应为吸热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH30.15mol和H2O 0.10mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在250mL容量瓶中定容成250mL烧碱溶液
B.用移液管移取25mL烧碱溶液于锥形瓶中并滴加几滴甲基橙指示剂
C.在天平上准确称取烧碱样品Wg,在烧杯中加蒸馏水溶解
D.将物质的量浓度为M mol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度为V1mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2mL
回答下列问题:
(1)正确的操作步骤的顺序是(用字母填写) .
(2)滴定管读数应注意 .
(3)操作E中的锥形瓶下垫一张白纸的作用是 .
(4)操作D中液面应调整到 , 尖嘴部分应 .
(5)滴定终点时锥形瓶内溶液的pH 约为 , 终点时颜色变化是 .
(6)若酸式滴定管没有用标准H2SO4润洗,会对测定结果有何影响(填“偏高”“偏低”或“无影响”,其它操作均正确)
(7)该烧碱样品的纯度计算式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com